Magne, F.; Gotteland, M.; Gauthier, L.; Zazueta, A.; Pesoa, S.; Navarrete, P.; Balamurugan, R. La relación Firmicutes/Bacteroidetes: ¿un marcador relevante de disbiosis intestinal en pacientes obesos? Nutrientes 2020, 12, 1474. https://doi.org/10.3390/nu12051474
Abstracto
La microbiota intestinal se está convirtiendo en una diana prometedora para el tratamiento o la prevención de trastornos inflamatorios y metabólicos en humanos. Muchos de los esfuerzos de investigación actuales se centran en la identificación de firmas microbianas específicas, más particularmente para aquellas asociadas con la obesidad, la diabetes tipo 2 y las enfermedades cardiovasculares. Algunos estudios han descrito que la microbiota intestinal de los animales obesos y de los seres humanos presenta una mayor proporción de Firmicutes/Bacteroidetes en comparación con los individuos de peso normal, proponiendo esta relación como un eventual biomarcador. En consecuencia, la relación Firmicutes/Bacteroidetes se cita con frecuencia en la literatura científica como un sello distintivo de la obesidad. El objetivo de la presente revisión fue discutir la validez de este marcador potencial, a partir de la gran cantidad de resultados contradictorios reportados en la literatura. Estas discrepancias podrían explicarse por la existencia de sesgos interpretativos generados por diferencias metodológicas en el procesamiento de las muestras y en el análisis de las secuencias de ADN, o por la caracterización generalmente deficiente de los sujetos reclutados y, más concretamente, por la falta de consideración de los factores asociados al estilo de vida que se sabe que afectan a la composición y/o diversidad de la microbiota. Por estos motivos, en la actualidad es difícil asociar la relación Firmicutes/Bacteroidetes con un determinado estado de salud y, más concretamente, considerarla como un sello distintivo de la obesidad.
1. Introducción
La microbiota intestinal es una comunidad compleja de microorganismos que habitan en el tracto gastrointestinal y que han establecido una estrecha relación simbiótica con su huésped humano. Desempeña un papel crucial en el mantenimiento de la salud, permitiendo el metabolismo de los componentes dietéticos no digeribles y la síntesis de algunas vitaminas, previniendo la colonización de patógenos y contribuyendo a la maduración y educación del sistema inmunológico [1]. La microbiota intestinal humana está compuesta principalmente por dos filos bacterianos dominantes, Firmicutes y Bacteroidetes, que representan más del 90% de la comunidad total, y por otros filos subdominantes, como Proteobacteria, Actinobacteria y Verrucomicrobia [2]. Esta composición permanece relativamente poco afectada por perturbaciones agudas, ya que su plasticidad le permite volver rápidamente a su composición inicial [3]. Sin embargo, está continuamente expuesto a diversos factores de estrés asociados con los estilos de vida modernos, incluidos, entre otros, el consumo de agua clorada y el de aditivos alimentarios y contaminantes como metales pesados, pesticidas, antibióticos, contaminantes orgánicos y micotoxinas. Estos factores podrían modificar crónicamente su composición (disbiosis), seleccionando microorganismos más virulentos que conducen a efectos deletéreos sobre la salud del huésped [3]. La disbiosis intestinal también se asocia con diversas afecciones patológicas que afectan al tracto gastrointestinal (diarrea, síndrome del intestino irritable) [4], al sistema inmunitario (alergia, esclerosis múltiple, diabetes tipo 1, enfermedades inflamatorias intestinales, artritis reumatoide) [4,5,6], al sistema nervioso central (enfermedades de Alzheimer y Parkinson, autismo) [6,7], así como el metabolismo energético del huésped (obesidad, diabetes tipo 2, aterosclerosis) [8], aunque aún no está claro si estas alteraciones son causa o consecuencia de estos trastornos. Más particularmente, la relación entre los dos filos dominantes, expresada como la relación Firmicutes/Bacteroidetes, se ha asociado con varias condiciones patológicas. En consecuencia, la microbiota intestinal se perfila como una diana prometedora para la prevención y el tratamiento nutricional o terapéutico de estas enfermedades.
Por lo tanto, es importante caracterizar las poblaciones bacterianas involucradas en la disbiosis, ya que esto podría ser útil para adoptar estrategias alternativas para el manejo de las enfermedades. Por ejemplo, el aumento de especies potencialmente patógenas podría tratarse mediante terapias antimicrobianas dirigidas, mientras que la desaparición de comensales beneficiosos podría abordarse mediante la administración de probióticos específicos como Lactobacillus rhamnosus GG, L. reuteri DSM 17938, L. plantarum DSM 9843 y Bifidobacterium lactis Bb-12 [9].
El objetivo general de esta revisión es discutir la relevancia de la relación Firmicutes/Bacteroidetes como marcador de obesidad. En primer lugar, describiremos la evidencia que sugiere una asociación entre la relación Firmicutes/Bacteroidetes y la obesidad, o rechaza esta relación. A continuación, expondremos las posibles razones de estas contradicciones, en particular las diferencias en los métodos de análisis de la microbiota, el control de los factores interferentes (dieta, antibióticos, etc.) y los posibles sesgos en el proceso de reclutamiento de los sujetos. En última instancia, volvimos a analizar los datos de la secuencia del gen ARNr 16S de nueve estudios publicados para permitir comparaciones directas entre su proporción Firmicutes/Bacteroidetes. Por lo tanto, mostraremos que la obesidad se asocia con múltiples firmas taxonómicas, lo que es consistente con la alta heterogeneidad del microbioma intestinal observada en la población sana.
2. La obesidad y su relación con el aumento de la relación Firmicutes/Bacteroidetes
La obesidad es una enfermedad compleja y multifactorial debido a varios factores, incluidos los antecedentes genéticos del huésped, la disminución de la actividad física y la ingesta excesiva de alimentos. En las últimas décadas, la microbiota intestinal se ha propuesto como un factor adicional que favorece el almacenamiento de grasa, el aumento de peso y la resistencia a la insulina [10]. De hecho, la microbiota intestinal está implicada en la homeostasis energética mediante la extracción de energía de los alimentos a través de procesos de fermentación y formación de ácidos grasos de cadena corta (AGCC) [11,12]. También aumenta la vascularización de las vellosidades, lo que conduce a una mejor absorción de nutrientes [13] y a una disminución de los niveles de AMPK y la ß-oxidación en el tejido muscular. Además, la microbiota modula la liberación del factor adiposo inducido en ayunas (Fiaf), un inhibidor de la actividad de la lipoproteína lipasa (LPL), lo que resulta en el posterior almacenamiento de triglicéridos en el tejido adiposo y el hígado [13]. Por último, influye en el desarrollo de endotoxemia metabólica e inflamación de bajo grado [14]. Además, se demostró que el fenotipo obeso en ratones es transmisible mediante el trasplante de la microbiota intestinal de ratones obesos convencionales [12,15] a animales libres de gérmenes de peso normal.
Posteriormente, los esfuerzos de investigación se centraron en la identificación de taxones bacterianos implicados en el desarrollo de la obesidad. Las alteraciones que afectan a los filos dominantes Firmicutes y Bacteroidetes se describieron por primera vez en animales obesos y sujetos que exhibieron una mayor abundancia de Firmicutes a expensas de Bacteroidetes [16]. Cuando estos sujetos fueron sometidos a una dieta restringida en calorías durante un año, mostraron un aumento de su abundancia de Bacteroidetes y la normalización de su relación Firmicutes/Bacteroidetes, en paralelo con la pérdida de peso. Estos estudios fueron respaldados por estudios en animales alimentados con dietas altas en grasas o fibra que mostraron una mayor abundancia de Firmicutes y Bacteroidetes, respectivamente [17,18]. Hallazgos similares se reportaron en niños que vivían en áreas rurales africanas, quienes consumían una dieta tradicional rica en fibra y mostraban mayores proporciones de Bacteroidetes y menores de Firmicutes, en comparación con los niños de países occidentales cuya dieta incluía grandes cantidades de proteínas, grasas, azúcar y almidón [19]. Con base en estos resultados y otros obtenidos de animales obesos y humanos [13,20,21,22,23,24,25], se ha propuesto que los Firmicutes fueron más efectivos en la extracción de energía de los alimentos que los Bacteroidetes, promoviendo así una absorción más eficiente de calorías y el posterior aumento de peso [25]. Esto podría estar relacionado con las observaciones de Turnbaugh et al. [21] en gemelos discordantes para obesidad; El microbioma del gemelo obeso estaba enriquecido en genes que codifican para transportadores de nutrientes, mientras que el del gemelo delgado estaba enriquecido en genes que codifican enzimas asociadas con el metabolismo de los carbohidratos [15]. Estos datos sugieren que las alteraciones en la composición/diversidad bacteriana se asocian generalmente con cambios en el perfil metabólico de la microbiota que también influyen en la salud del huésped. En consecuencia, en la última década, la relación Firmicutes/Bacteroidetes se ha considerado con frecuencia como un posible sello distintivo de la obesidad [26,27].
3. Controversias sobre la alteración de la relación Firmicutes/Bacteroidetes en la obesidad
Sin embargo, en oposición a estos resultados, varios estudios no observaron ninguna modificación de este parámetro o incluso informaron una disminución de la relación Firmicutes/Bacteroidetes en animales obesos y humanos [11,28,29,30,31,32]. El hecho de que, en la mayoría de los estudios, los pacientes obesos mostraran menor diversidad bacteriana que los sujetos delgados, sugiere la existencia de otros cambios composicionales a nivel de familia, género o especie, que podrían ser más relevantes que la relación Firmicutes/Bacteroidetes [33].
Con respecto a este punto, la hipótesis de la endotoxemia metabólica propone que el aumento de la adiposidad y el desarrollo de inflamación sistémica podrían deberse a la exposición crónica al lipopolisacárido (LPS), una molécula proinflamatoria derivada de bacterias Gram-negativas, que pasaría de la luz intestinal al torrente sanguíneo [14]. Esta hipótesis no encaja con la disminución de la abundancia de Bacteroidetes reportada en la obesidad, ya que este filo es el principal grupo de bacterias Gram-negativas en la microbiota intestinal [28]. Tal discrepancia podría explicarse por el hecho de que la actividad endotóxica del LPS de las bacterias pertenecientes al filo Bacteroidetes se considera inferior a la de otras bacterias Gram-negativas como las pertenecientes al filo Proteobacteria. Curiosamente, también se han observado aumentos de Proteobacteria en sujetos o animales obesos, y la administración de Enterobacter, un miembro del filo Proteobacteria, en ratones libres de gérmenes da como resultado el desarrollo de obesidad y resistencia a la insulina en estos animales [34,35,36].
Por otro lado, el aumento de la relación Firmicutes/Bacteroidetes no se correlacionó con la producción de AGCC observada en individuos obesos. De hecho, MacFarlane et al. informaron que los Bacteroidetes producen principalmente acetato y propionato, mientras que los Firmicutes producen más butirato [36]. El butirato se considera una molécula promotora de la salud debido a su capacidad para [37] aumentar la sensibilidad a la insulina [38], ejercer actividades antiinflamatorias [39], regular el metabolismo energético y aumentar la expresión génica de la leptina [40]. El propionato, en el colon, estimula la liberación de GLP-1 y PYY por parte de las células L-entero-endocrinas, lo que resulta en la inhibición del apetito [41]. También puede llegar a la circulación portal, siendo captado principalmente por el hígado donde participa en la gluconeogénesis hepática y reduce la expresión de enzimas involucradas en la síntesis de novo de ácidos grasos y colesterol [42]. El acetato también se absorbe y llega a la circulación sistémica y a los órganos periféricos, incluidos el tejido adiposo, los músculos y el cerebro. En el hígado, a diferencia del propionato, estimula la síntesis hepática de lípidos [43], contribuyendo a la dislipidemia. En el cerebro, activa el sistema nervioso parasimpático, promoviendo la secreción de insulina y grelina, por parte del páncreas y la mucosa gástrica, respectivamente [44]. Estos eventos dan como resultado un aumento del almacenamiento de grasa y el apetito que contribuyen a la obesidad. Sobre la base de estos resultados, el acetato generalmente se considera más obesogénico. El aumento de la relación Firmicutes/Bacteroidetes en individuos obesos significaría una mayor producción de butirato y menor propionato y acetato en estos sujetos, hallazgo que es parcialmente contradictorio con los respectivos efectos antiobesogénicos y obesogénicos de estos AGCC. Una explicación es que las bacterias productoras de butirato disminuyen en los individuos obesos y son reemplazadas progresivamente por otras bacterias pertenecientes al mismo filo, lo que resulta en una menor producción de butirato en la luz colónica. Por ejemplo, se ha reportado un aumento de la abundancia de Staphylococcus spp. y Lactobacillus reuteri (ambos del filo Firmicutes) en personas obesas, y se correlacionó positivamente con la ingesta de energía y la proteína >C reactiva (PCR) plasmática, respectivamente [23,45]. Por el contrario, la disminución de la abundancia del Faecalibacterium prausnitzii productor de butirato (filo Firmicutes) se correlacionó negativamente con la intensidad de la inflamación de bajo grado en sujetos obesos y pacientes con diabetes tipo 2 [46,47]. El estado de obesidad también se asoció con una menor abundancia de A. muciniphila (filo Verrucomicrobia), una bacteria degradadora de mucina que contribuye a la estabilización de la función de barrera intestinal, la secreción de péptidos antibacterianos y el control de la inflamación [48,49].
Por otro lado, la heterogeneidad de los resultados en humanos, en cuanto a la relación Firmicutes/Bacteroidetes, podría deberse al número insuficiente de sujetos incluidos en la mayoría de los estudios, lo que hace que su poder estadístico sea insuficiente para detectar pequeñas variaciones. Tratando de aclarar esta cuestión, se han realizado varios metaanálisis que agrupan los amplicones de secuenciación de alto rendimiento obtenidos de diferentes estudios en pacientes obesos [50,51,52]. Con este objetivo, todas las secuencias se descargaron y procesaron utilizando una canalización única. Se examinaron de novo para eliminar las secuencias de quimeras y se asignaron a unidades taxonómicas operativas (OTU). En consecuencia, se evitaron todos los posibles sesgos asociados con las diferencias metodológicas (que se describen a continuación) y se compararon o agruparon los datos de los estudios individuales para el análisis general. Después de agrupar las secuencias de acuerdo con el Índice de Masa Corporal (IMC) del sujeto, no se detectaron diferencias en la abundancia de Firmicutes y Bacteroidetes ni en la relación Firmicutes/Bacteroidetes entre individuos obesos y de peso normal. Solo se detectó una pequeña reducción de la diversidad en la microbiota de los sujetos obesos. Los autores proyectaron que fue necesario reclutar aproximadamente 160.000, 6300, 1600 y 700 individuos por grupo para detectar una diferencia del 1%, 5%, 10% y 15% en la relación Firmicutes/Bacteroidetes, respectivamente [50], es decir, mucho mayor que el número de sujetos reclutados en la mayoría de estos estudios. En resumen, estos datos indican que la mayoría de los estudios carecen de la potencia necesaria para detectar diferencias modestas entre sujetos sanos y obesos, lo que sugiere que la relación Firmicutes/Bacteroidetes no es un marcador robusto de la disbiosis del microbioma asociada con la obesidad.
4. Origen de las disparidades en la investigación del microbioma intestinal asociado a la obesidad. Las discrepancias metodológicas entre los estudios
Los resultados discrepantes informados anteriormente también pueden explicarse por diferencias en el procesamiento de la muestra y el análisis de datos, incluido el método de extracción de ADN, la selección de la región de ARNr 16S amplificada (elección de los cebadores), el método de secuenciación y el análisis bioinformático (base de datos de taxonomía y algoritmo de asignación de taxonomía utilizados) [51,53,54]. Por lo tanto, es difícil eliminar el sesgo introducido por el diseño del cebador, la preparación de bibliotecas, los métodos de aislamiento de ADN y los artefactos de amplificación por PCR, que pueden dar lugar a la sobrerrepresentación o infrarrepresentación de taxones individuales dentro de comunidades complejas [51,53,54]. Además, el almacenamiento de muestras también puede influir en la identificación de comunidades bacterianas. Si bien la refrigeración a 4 °C no afectó significativamente la composición microbiana fecal y su diversidad, en comparación con las muestras de control almacenadas a -80 °C, el uso de tampones conservantes (RNAlater, OMNIgene.GUT, Tris-EDTA) pareció alterar el perfil de la microbiota [55]. Esta observación es importante ya que la congelación rápida a -80 °C, comúnmente considerada como la mejor práctica, no siempre es practicable en estudios que involucran la recolección de muestras en el domicilio de los sujetos [55]. Por el contrario, los protocolos de extracción de ADN basados en el uso de fenol:cloroformo:alcohol isoamílico son más eficientes en la extracción de ADN de bacterias grampositivas [53]. En otro estudio, se extrajo ADN bacteriano de muestras fecales obtenidas a través del Proyecto Microbioma Humano utilizando el mismo protocolo y posteriormente amplificado con diferentes cebadores dirigidos a las regiones V1-3/V2 o V3-5/V4 del ARNr. En comparación con la región V3-5/V4, el análisis de la región V1-3/V2 muestra un enriquecimiento en las poblaciones de Erysipelotrichi y Verrucomicrobia y un agotamiento de Actinobacteria y Gamma Proteobacteria [53]. Los desajustes de cebadores pueden representar otro problema, ya que producen una amplificación selectiva y luego impiden la correcta evaluación de la diversidad bacteriana [56]. Las secuencias no emparejadas correctamente por los cebadores no se amplifican correctamente, lo que lleva a una menor representación de los microorganismos correspondientes o incluso a su no identificación cuando el número de secuencias amplificadas está por debajo del límite de detección [57]. En consecuencia, es necesaria una evaluación de la cobertura bacteriana para interpretar correctamente los datos obtenidos de las muestras mediante secuenciación de nueva generación (NGS) [57]. Sin embargo, los estudios que utilizan el mismo conjunto de cebadores también han reportado resultados contradictorios con respecto a la composición de la microbiota intestinal [21,58,59], lo que sugiere que el sesgo relacionado con los cebadores no es la razón principal de las discrepancias observadas entre los estudios [51].
Otro factor importante es la plataforma utilizada para secuenciar los amplicones de ARNr 16S. Actualmente existen varias plataformas (Ion Torrent PGM, Illumina MiSeq, Illumina HiSeq y Roche GS FLX+), que utilizan diferentes químicas de secuenciación y también pueden introducir sesgos internos, por ejemplo, influyendo en la detección y abundancia de microorganismos con bajo o alto contenido genómico de GC [60]. Además, no se puede descartar un eventual impacto de los adaptadores y códigos de barras agregados a los cebadores de secuenciación, que son específicos para cada plataforma [60].
Para determinar cómo las plataformas de secuenciación pueden afectar a los resultados de la composición de la microbiota, se analizó la microbiota del ciego de pollo a través de tres plataformas de secuenciación diferentes (Illumina MiSeq, Ion Torrent PGM y Roche 454 GS FLX) utilizando el mismo conjunto de cebadores (8F y 338R) [60]. Los autores observaron diferencias en la abundancia relativa de géneros específicos según la plataforma utilizada, confirmando estudios previos [61,62,63]. A pesar de las diferencias filogénicas inducidas por el diferente desempeño de las tres plataformas de secuenciación, los autores observaron que la discriminación de la muestra según el tratamiento persistía, independientemente de la plataforma utilizada, lo que sugiere que las conclusiones biológicas seguían siendo válidas [60]. Actualmente se dispone de varios conductos para eliminar las secuencias quiméricas generadas por las plataformas de secuenciación. Sin embargo, pueden proporcionar resultados discrepantes. Por ejemplo, en un estudio en el que se compararon tres canales de análisis (QIIME, Mothur y MG-RAST) para caracterizar la microbiota de recién nacidos prematuros mediante secuenciación NGS [64], los autores observaron diferencias significativas en el número efectivo de géneros detectados según el programa utilizado. Además, también se observaron diferencias en la proporción de algunos filos. Proteobacteria fue detectada en menor abundancia por MG-RAST, mientras que Mothur detectó Actinobacteria en una abundancia ligeramente mayor [64]. Por lo tanto, el estudio de comunidades microbianas complejas requiere la selección de los enfoques metodológicos más precisos y apropiados para generar y analizar la secuenciación del gen 16S rRNA. Estos sesgos son inevitables y pueden afectar los resultados generales de un estudio.
Los aspectos tecnológicos, por lo tanto, pueden tener un fuerte impacto en la identificación de taxones bacterianos, eclipsando las diferencias biológicas en las muestras, especialmente cuando el tamaño de la muestra es pequeño [51]. Este problema se ilustra con los resultados de un metaanálisis que utilizó amplicones de estudios de secuenciación de alto rendimiento en sujetos obesos y mostró que la composición de la microbiota intestinal se agrupó por estudio en lugar de por IMC del sujeto, lo que sugiere que el efecto por estudio fue mayor que el efecto biológico [51].
5. Origen de las disparidades en la investigación del microbioma intestinal asociado a la obesidad. La selección de las asignaturas incluidas en los estudios
Las comparaciones de los resultados entre los estudios suelen complicarse por la insuficiente caracterización de las poblaciones estudiadas y por el hecho de que muchos factores asociados al estilo de vida, no considerados en los estudios, contribuyen a configurar la composición de la microbiota intestinal. Por lo tanto, los resultados discrepantes observados entre los estudios que evaluaron la relación Firmicutes/Bacteroidetes en sujetos obesos y delgados podrían explicarse por el hecho de que estas covariables no han sido consideradas adecuadamente. En la Tabla 1 se describen los diferentes parámetros relacionados con el tema que fueron considerados en los principales estudios de la última década. Se puede observar que algunos factores como la ingesta de antibióticos o factores dietéticos como probióticos, prebióticos y simbióticos no se reportan, y que la descripción cualitativa y cuantitativa de la dieta, así como la intensidad de la actividad física, están en gran medida descontroladas. La información sobre la ingesta de macronutrientes, micronutrientes y no nutrientes, como las fibras dietéticas y los fitoquímicos, es importante, teniendo en cuenta que parte de ellos pueden llegar al colon y afectar a la microbiota. Además, no está claramente establecido si los cambios observados en la microbiota intestinal de los sujetos obesos se deben a variaciones en su ingesta dietética o a la obesidad per se [65]. Este fenómeno también está bien descrito para los carbohidratos no digeribles y también para las proteínas de la dieta que pueden llegar al colon e influir en la composición bacteriana y la producción microbiana de AGCC y otros metabolitos potencialmente tóxicos (H2S, p-cresol, fenol, NH3, etc.). El hierro no absorbido de la dieta (incluidos los suplementos de hierro) también afecta a la microbiota, así como a los compuestos fenólicos de la dieta que pueden actuar como prebióticos. El impacto de los lípidos en la dieta es poco conocido; Los animales alimentados con dietas con alto contenido de grasa (suprafisiológicas) exhiben disbiosis intestinal, pero no está claro si esto también ocurre en humanos [66]. Curiosamente, Hildebrandt et al. demostraron que las ratas alimentadas con una dieta alta en grasas mostraban disbiosis intestinal, independientemente de su fenotipo obeso [18]. Se ha demostrado que los aditivos alimentarios, como los edulcorantes bajos en calorías y los emulsionantes, alteran la microbiota, aumentando su virulencia potencial y favoreciendo los trastornos metabólicos en animales y humanos [67,68]. Por último, una serie de contaminantes, incluidos los metales pesados, los contaminantes orgánicos persistentes y los plaguicidas, que actualmente están aumentando en el medio humano, también alteran el ecosistema microbiano intestinal [69]. En consecuencia, la identificación y caracterización de estos factores de confusión es, por lo tanto, particularmente importante cuando se comparan poblaciones delgadas y obesas, que difieren claramente por sus estilos de vida. No tenerlos en cuenta puede generar sesgos y dar lugar a interpretaciones erróneas de los resultados.
Tabla 1. Consideración de los factores que afectan a la microbiota y que deben ser controlados, en estudios que analizan la microbiota en adultos obesos y normopesos. Estos factores incluyen la ingesta de antibióticos y la de prebióticos/probióticos antes/durante el estudio, la caracterización de la dieta consumida por los sujetos, la intensidad de su actividad física y la presencia de patologías interferentes que aparecen como criterios de exclusión. Solo se seleccionaron los estudios que analizaban la microbiota a través de métodos moleculares (qPCR o secuenciación). Cuando se dispone de ellos, se muestran los resultados correspondientes a la abundancia relativa de Firmicutes y Bacteroidetes y a la relación Firmicutes/Bacteroidetes.
Tabla 1. Consideración de los factores que afectan a la microbiota y que deben ser controlados, en estudios que analizan la microbiota en adultos obesos y normopesos. Estos factores incluyen la ingesta de antibióticos y la de prebióticos/probióticos antes/durante el estudio, la caracterización de la dieta consumida por los sujetos, la intensidad de su actividad física y la presencia de patologías interferentes que aparecen como criterios de exclusión. Solo se seleccionaron los estudios que analizaban la microbiota a través de métodos moleculares (qPCR o secuenciación). Cuando se dispone de ellos, se muestran los resultados correspondientes a la abundancia relativa de Firmicutes y Bacteroidetes y a la relación Firmicutes/Bacteroidetes.
| Población | Factores antropométricos y bioquímicos | Factores que influyen en la microbiota intestinal | Análisis de la microbiota intestinal (Ob vs. Nw) | Ref | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| País | Sujetos reclutados/tamaño de la muestra | Edad (años) 1 | IMC (kg/m2) 1 | Parámetros bioquímicos | Antibiótico 2 | Dieta | Ingesta de prebióticos/probióticos | Actividad física | Factores de exclusión | Método | F 3 | B 3 | F/B 4 | |
| Brasil | Ob Hembra = 15Nw Hembra = 17 | ND | 34.5 (32.8–36.7) *21.2 (20.6–21.9) * | FPG, FPI, TC, HDL LDL, TG | ≤3 meses | Sí | ND | ND | Enfermedades diagnosticadas, Embarazo, Lactancia | qPCR | ND | ND | ND | [70] |
| Canadá | Dos/Ow = 11Nw = 11 | 42,5 ± 3.935,8 ± 4,2 | >25≤25 p. m. | ND | Últimos 5 años | Sí | ND | ND | Todos los medicamentos que influyen en las funciones gastrointestinales, Enfermedades inflamatorias intestinales, Malabsorción, Infección gastrointestinal, Síndrome del intestino corto, Enfermedad o cirugía que requiere hospitalización | Secuenciación | ↑ | = | ↑ | [71] |
| China | Ob Hembra = 20Ob Macho = 38Ow Hembra = 55Ow Macho = 115Hembra = 168Nw Macho = 93Under Hembra = 49Under Macho = 13 | 35,5 ± 12.734,7 ± 12.538,1 ± 12.641,7 ± 15.935,6 ± 14.337,8 ± 17.338,0 ± 25.621,5 ± 5,5 | 31,7 ± 4.331,2 ± 3.224,7 ± 1.325,1 ± 1.220,7 ± 1.321,3 ± 1.317,5 ± 1.016,7 ± 1,1 | ND | ≤2 semanas | ND | ND | ND | Diabetes, diarrea, estreñimiento, medicamentos a largo plazo | Secuenciación | = | = | ND | [72] |
| Alemania | Dos = 33Ow = 35Nw = 30 | 47 ± 13 | ≥30.025.0–29.918.5–24.9 | ND | ≤6 meses | ND | ND | ND | ND | qPCR | ↓ | ↑ | ↓ | [30] |
| Francia | Dos = 68Nw = 47 | 50,5 ± 14.442,6 ± 17,5 | 43,6 ± 7.822,1 ± 1,8 | ND | ≤1 mes | ND | ND | ND | Bypass gástrico, Cáncer de colon, Enfermedades inflamatorias intestinales, Diarrea | qPCR | = | = | ND | [73] |
| Francia | Dos = 20Nw = 20 | 17–72 **13–68 ** | 47,1 ± 10.720,7 ±2,0 | ND | ND | ND | Sí (solo probióticos) | ND | ND | qPCR | = | ↓ | ↑ | [24] |
| India | Ob = 5Nw = 5 | 49 ± 3.325 ± 9,4 | ≥30.018.5–24.9 | ND | ≤3 meses | ND | Sí | ND | ND | Secuenciación | = | = | = | [31] |
| Japón | Ob = 33No ob = 23 | 54,4 ± 8.245,6 ± 9,6 | 27,8 ± 2.518,6 ± 1,2 | TC, TG, HDL, ALT, AST, HbA1c | Sí | ND | ND | Sí | Enfermedades crónicas intestinales o hepáticas, Cáncer colorrectal, Quimioterapia o radioterapia, Inmunosupresores | T-RFLP y secuenciación | = | ↑ | ↓ | [74] |
| Tailandia | Dos = 11Ow = 10Nw = 21 | 28,45 ± 2.526,40 ± 2.827,71 ± 1,9 | 33,56 ± 127,38 ± 0,620,66 ± 0,4 | FPG, Lípidos, TG, TC, HDL, LDL | ≤2 semanas | ND | ND | ND | Enfermedades inflamatorias crónicas, Diarrea | qPCR | ↓ | ↓ | ND | [75] |
| Reino Unido | Dos = 18Nw = 14 | 36.7 ± 2.3º | 35,4 ± 0,9ND | ND | Durante el transcurso del estudio | ND | ND | ND | Síndrome metabólico Problemas gastrointestinales | PESCADO | ND | = | ND | [29] |
| Ucrania | Ob = 11Ow = 16Nw = 27Under = 7 | 44.2 (Media) | ≥3025–29,9 **18,5–24,9 **< 18,5 | ND | ND | ND | ND | Sí | Enfermedades oncológicas, Enfermedades endocrinológicas, Anorexia, Trastornos psiquiátricos, Enfermedades crónicas | qPCR | ↑ | ↓ | ↑ | [76] |
| Estados Unidos | Ob = 3Nw = 3 | 35,7 ± 4.236,7 ± 4,0 | 48,3 ± 7.722,7 ± 2,3 | ND | ≤3 meses | ND | Sí | ND | ND | Secuenciación | ND | = | ND | [28] |
| Estados Unidos | Dos = 9Nw = 12 | 35,8 ± 10.632,8 ± 9,2 | 40,4 ± 4.623,4 ± 1,7 | Glc, FPG, Ins, FPI | ≤3 meses | Sí | Sí (solo probióticos) | ND | Fumadores, Enfermedades gastrointestinales, Antiácidos y laxantes, Tiempo de tránsito | Secuenciación | = | = | = | [11] |
| Estados Unidos | Pares de gemelos Ob = 33Par de gemelos discordantes = 7Nw pares de gemelos = 14 | 25–32 ** | ≥3018.5–24.9 ** | ND | ≤6 meses | Sí | ND | ND | Cuestionario médico y de estilo de vida detallado (no detallado) | Secuenciación | = | ↓ | ND | [21] |
| Estados Unidos | Dos = 12Nw = 5 | 21–65 **32–50 ** | 30–43 **ND | ND | ND | ND | ND | ND | ND | Secuenciación | ↑ | ↓ | ↑ | [16] |
| Estados Unidos | Dos = 27Ow = 27Nw = 27 | 33 ± 13.3 | 28.3 ± 7.01 | ND | Sí | Sí | Sí | ND | ND | Secuenciación | ND | ND | ND | [77] |
1 Valores expresados como media ± SEM o [rango]; 2 Tiempo previo al estudio; 3 Abundancia relativa de Firmicutes (F) y Bacteroidetes (B); Proporción; 4 Relación Firmicutes/Bacteroidetes; * Percentil de IMC para la edad; **Gamas; SEM. error estándar de la media; IMC. índice de masa corporal; Ob. obeso; Ow. sobrepeso; Nw. Peso normal; ND. no determinado; Secuenciación. pirosecuenciación del ADNr 16S; T-RFLP. Polimorfismo de longitud del fragmento de restricción terminal; PESCADO. Hibridación fluorescente in situ; ↑. Aumentado significativamente; ↓. Disminuyó significativamente; =. No es significativamente diferente; GLC. glucosa; FPG. Glucosa plasmática en ayunas; INS. Insulina; FPI. Insulina plasmática en ayunas; FC. Calprotectina fecal; ALT. Alanina aminotransferasa; AST. Aspartato aminotransferasa; HDL. colesterol de lipoproteínas de alta densidad; LDL. Lipoproteína de baja densidad; Colesterol; TG. Triglicéridos; TC. Colesterol total; HbA1c. hemoglobina glicosilada (A1c).
La actividad física es otra variable de confusión importante; Determina la motilidad intestinal y el tiempo de tránsito de la campana a través de los diferentes segmentos del tracto gastrointestinal, lo que, a su vez, afecta a la composición de la microbiota [78]. La actividad física se ha correlacionado con la relación Firmicutes/Bacteroidetes en animales [79] y humanos, independientemente de la dieta [80]. Además, la frecuencia y la intensidad de la actividad física también determinan la proporción de grasa y masas magras, lo que finalmente hace que la estratificación del IMC sea irrelevante. Así, un sujeto sedentario puede tener un peso normal (es decir, con un IMC < 24,9) pero tener una masa grasa desequilibrada, mientras que un deportista puede tener un IMC correspondiente al de un sujeto con sobrepeso u obesidad, pero con baja masa grasa y alta masa magra [81]. El impacto de estas diferencias individuales en la composición de la microbiota sigue siendo desconocido. Por lo tanto, podría ser útil considerar otros parámetros además del IMC para determinar si el individuo está sano o no. De hecho, se ha demostrado que la riqueza de la microbiota intestinal humana está inversamente correlacionada con marcadores metabólicos como la adiposidad general, la resistencia a la insulina, la dislipidemia y la inflamación de bajo grado [59,82]. Curiosamente, la clasificación de los sujetos delgados y obesos según su estado de salud cardiometabólica mostró mejores diferencias en la comunidad microbiana [83].
Dentro de un rango determinado de IMC, los taxones bacterianos marcadores asociados con la obesidad y los trastornos cardiometabólicos se exacerbaron en individuos no sanos [83]. Como se ha indicado anteriormente, estos parámetros pueden verse alterados en sujetos delgados, mientras que pueden estar en el rango normal para sujetos con IMC elevado, lo que limita la interpretación de los cambios observados en la composición de la microbiota. Por lo tanto, es necesario caracterizar mejor a los individuos reclutados en los estudios para controlar los factores de confusión y evitar una asociación errónea entre la obesidad y la microbiota.
6. ¿La obesidad podría estar asociada con múltiples firmas taxonómicas?
El patrón de la microbiota intestinal asociado a la obesidad no es homogéneo en todo el mundo y difiere según la ubicación geográfica de los estudios [84,85,86,87]. Los microbios en el tracto gastrointestinal están sometidos a una presión selectiva debido en gran medida a los estilos de vida que cambian según el nivel socioeconómico que prevalece en los diferentes continentes y países. Estas diferencias geográficas incluyen el acceso a materiales alimenticios específicos, diferencias en los antecedentes genéticos de los habitantes, incluida la presencia de polimorfismos de un solo nucleótido, y diferencias en los requisitos energéticos del huésped debido a las condiciones climáticas [19,88,89]. Por ejemplo, los inuits viven en un clima frío y en su mayoría tienen acceso a una dieta rica en proteínas y grasas animales que, a su vez, determina una composición específica de la microbiota mediante la selección de bacterias capaces de metabolizar estos macronutrientes, independientemente de su IMC [90]. Un metaanálisis reveló que la proporción Firmicutes/Bacteroidetes era mayor en las poblaciones que vivían en latitudes altas, lo que sugiere que la extracción de energía de los alimentos por parte de la microbiota intestinal podría ser mayor en estas regiones [88]. Este hallazgo está respaldado por un estudio realizado en ratones mantenidos en un ambiente frío que también mostró una mayor proporción Firmicutes/Bacteroidetes en estos animales, similar a la observada en animales obesos o alimentados con una dieta alta en grasas [91]. En particular, este estudio muestra que la microbiota intestinal contribuye a la adaptación a la exposición al frío a través de su capacidad para recolectar energía.
7. La heterogeneidad del microbioma intestinal en las poblaciones
Para evaluar la relevancia de la relación Firmicutes/Bacteroidetes como firma taxonómica de la obesidad, utilizamos datos de la composición de la microbiota de nueve estudios publicados realizados en siete países (EE. UU., Reino Unido, India, Pakistán, Chile, Argentina y Colombia) e incluyendo a 728 sujetos sanos. Se recogieron datos de secuencias del gen 16S rRNA de alto rendimiento de estudios previos, correspondientes a regiones hipervariables V3-V4 o V4 y generados por la plataforma Illumina MiSeq (Tabla 2). Para permitir comparaciones directas entre secuencias de diferentes estudios, todas las lecturas se filtraron utilizando la tubería DADA2, luego se alinearon y recortaron a la misma longitud (80 pb) usando Mothur, seguida de la identificación taxonómica usando la tubería DADA2 basada en la identificación de variantes de secuencia exactas [92]. Consideramos que una longitud de secuencia de 80 pb era adecuada para analizar las comunidades microbianas a nivel de filo (menos del 0,02% de las lecturas no fueron asignadas). Utilizando un pipeline único y lecturas generadas por una misma plataforma de secuenciación, esperábamos eliminar todo el sesgo generado por las herramientas de secuenciación y bioinformática, como se ha comentado anteriormente. Posteriormente, se analizó la abundancia relativa de Firmicutes y Bacteroidetes y su proporción. En general, los datos indican que la abundancia de Firmicutes en la microbiota intestinal de individuos sanos varía entre el 11% y el 95% y la de Bacteroidetes entre el 0,6% y el 86,6% (Figura 1). Teniendo en cuenta esta variabilidad, parece difícil observar cambios significativos para estos dos filos en las personas obesas. En su meta-análisis, Finucane et al. observaron que las variaciones para la abundancia de Firmicutes y Bacteroidetes fueron mucho mayores entre los estudios que entre los individuos delgados y obesos dentro de cualquier estudio [52]. De acuerdo con estos hallazgos, recientemente observamos una alta variabilidad tanto de Firmicutes como de Bacteroidetes, entre el 25%-67% y el 4%-64% respectivamente, en la microbiota fecal de jóvenes voluntarios chilenos sanos, a pesar de los rigurosos criterios de inclusión que incluyen el control de marcadores antropométricos y bioquímicos, biomarcadores de inflamación sistémica y colónica (IL-6 plasmática y proteína C reactiva de alta sensibilidad y calprotectina fecal, respectivamente) y la ingesta dietética [93]. Una vez más, la heterogeneidad de la dieta es probablemente el principal factor que explica tales variaciones en la población sana, lo que podría dificultar la identificación de firmas microbianas específicas. Por ejemplo, por un lado, Wu et al. demostraron en 100 individuos sanos con hábitos dietéticos conocidos que la microbiota de los que consumían dietas basadas en proteínas y grasas estaba enriquecida con Bacteroides, mientras que la de los que consumían dietas basadas en carbohidratos estaba enriquecida con Prevotella [59], resultados a partir de los cuales estos autores formularon el concepto de “enterotipo”. Por otro lado, Balamurugan et al. compararon la microbiota intestinal de una población tribal (malayalis) que vivía en la parte norte de Tamil Nadu (India) que consumía una dieta restringida debido a creencias culturales y religiosas, con la de aldeanos sanos de la misma región como controles. Ambas poblaciones exhibieron una alta abundancia de Firmicutes (85.9% y 63.5%, para los Malaiyalis y controles, respectivamente) y una baja abundancia de Bacteroidetes (2.65% y 0.45%, respectivamente), resultando en una relación Firmicutes/Bacteroidetes muy alta (34.0 y 92.9, respectivamente), aunque los individuos de ambas poblaciones eran magros [94]. A pesar de que la población de Malaiyalis tenía una dieta restringida y homogénea, se observó una alta variación en las proporciones tanto de Firmicutes como de Bacteroidetes, lo que confirma que otros factores además de la dieta influyen en esta proporción.
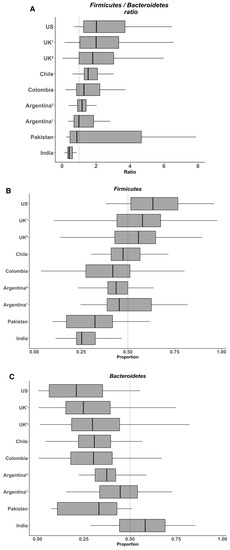
Figura 1. Variabilidad de la relación Firmicutes/Bacteroidetes (A) y de la abundancia relativa de Firmicutes (B) y Bacteroidetes (C) en la microbiota intestinal de varias poblaciones sanas. Los diagramas de caja se construyeron utilizando R. En los diagramas de caja y bigotes, la línea muestra la mediana; la caja, el rango intercuartílico; y los bigotes, los valores más altos y más bajos.
Tabla 2. Descripción de los estudios considerados en este estudio para evaluar la variabilidad de los Firmicutes y Bacteroidetes.
| País | Número de acceso | Eficaz & | Edad (años) | IMC (kg/m2) | Plataforma de secuenciación | Región hipervariable | Ref |
|---|---|---|---|---|---|---|---|
| Estados Unidos | PRJNA290926 | 68 | 53.1 ± 10.8 | 22.0 ± 1.9 | MiSeq Illumina | Región V4 | [95] |
| Reino Unido 1 | PRJEB6702 | 230 | 61.2 ± 10.1 | 22.4 ± 1.8 | MiSeq Illumina | Región V4 | [96] |
| Reino Unido 2 | PRJEB6705 | 189 | 60.0 ± 9.5 | 22.3 ± 1.8 | MiSeq Illumina | Región V4 | [96] |
| Pakistán | PRJNA554535 | 20 | 37.7 ± 12.1 | 22.08 ± 3.1 | MiSeq Illumina | Región V3–V4 | [97] |
| India | PRJEB28290 | 80 | Rango 18–55 * | 23.9 ± 3.2 * | MiSeq Illumina | Región V3–V4 | [98] |
| Colombia | PRJEB33360 | 83 | 52.1 ± 18.6 | 25.1 ± 3.9 | MiSeq Illumina | Región V3–V4 | [99] |
| Chile | PRJEB16755 | 32 | 25.0 ± 3.9 | 22.5 ± 1.6 | MiSeq Illumina | Región V3–V4 | [93] |
| Argentina 1 | PRJNA503303 | 28 | 35.2 ± 8.3 * | 23.9 ± 3.4 * | MiSeq Illumina | Región V3–V4 | [100] |
| Argentina 2 | Datos personales** | 28 | 40.2 ± 4.4 | 22.6 ± 2.0 | MiSeq Illumina | Región V4 | Este estudio |
& Eficaz obtenido después del procesamiento bioinformático; * Datos obtenidos de la publicación de datos (no recalculados debido a la falta de datos individuales); ** Datos enviados para su publicación, proporcionados por Susan Pesoa, coautora de este trabajo; Reino Unido 1, Reino Unido 2, Argentina 1 y Argentina 2 son estudios reportados en la Figura 1.
8. Conclusiones
En resumen, la abundancia relativa de los filos Firmicutes y Bacteroidetes es muy variable entre sujetos de una misma población. Esto se debe probablemente a muchos factores asociados al estilo de vida, como la dieta, la actividad física, los aditivos y contaminantes alimentarios, el consumo de antibióticos, la actividad física, entre otros, que influyen en la composición de la microbiota en el tracto gastrointestinal. Esto podría explicar los resultados contradictorios observados al comparar la microbiota entre sujetos de peso normal y obesos, lo que dificulta la asociación de la relación Firmicutes/Bacteroidetes con un determinado estado de salud. Aunque la microbiota intestinal podría contribuir al desarrollo de la obesidad, los datos que sugieren una asociación entre la obesidad y las alteraciones de la relación Firmicutes/Bacteroidetes no son convincentes. Por lo tanto, en futuros estudios es necesario mejorar la caracterización de los sujetos e identificar claramente las covariables que pueden afectar a la composición de la microbiota e interferir en la interpretación de los resultados. Además, el concepto de una firma taxonómica única asociada con la obesidad parece comprometido. En lugar de investigar los marcadores taxonómicos de la obesidad per se, los estudios del microbioma intestinal asociados a la obesidad deben centrarse en identificar marcadores taxonómicos para estratificar a los pacientes en subgrupos. La introducción de la estratificación del microbioma de los pacientes mejoraría el manejo de la obesidad al personalizar las decisiones de tratamiento a través de la manipulación directa de los microbiomas de los pacientes.

