Companys, J.; Gosalbes, M.J.; Pla-Pagà, L.; Calderón-Pérez, L.; Llauradó, E.; Pedret, A.; Valls, R.M.; Jiménez-Hernández, N.; Sandoval-Ramirez, B.A.; del Bas, J.M.; et al. Gut Microbiota Profile and Its Association with Clinical Variables and Dietary Intake in Overweight/Obese and Lean Subjects: A Cross-Sectional Study. Nutrients 2021, 13, 2032. https://doi.org/10.3390/nu13062032
Abstracto
Nuestro objetivo fue diferenciar la composición de la microbiota intestinal de sujetos con sobrepeso/obesidad y delgados y determinar su asociación con las variables clínicas y la ingesta dietética. Se realizó un estudio transversal con 96 sujetos con sobrepeso/obesidad y 32 sujetos delgados. Los parámetros antropométricos se asociaron positivamente con Collinsella aerofaciens, Dorea formicigenerans y Dorea longicatena, que presentaron mayor abundancia en sujetos con sobrepeso/obesidad. Además, diferentes géneros de Lachnospiraceae se asociaron negativamente con la grasa corporal, el LDL y el colesterol total. Los ácidos grasos saturados (AGS) se asociaron negativamente con el género Intestinimonas, un biomarcador del grupo de sobrepeso/obesidad, mientras que los AGS se asociaron positivamente con Roseburia, un biomarcador para el grupo delgado. En conclusión, Dorea formicigenerans, Dorea longicatena y Collinsella aerofaciens podrían considerarse biomarcadores de obesidad, Lachnospiraceae se asocia con factores de riesgo cardiovascular lipídico. Los AGS mostraron perfiles de asociación opuestos con bacterias productoras de butirato dependiendo del IMC. Así, la relación entre dieta y microbiota abre nuevas herramientas para el manejo de la obesidad.
Palabras clave:
obesidad; microbiota intestinal; ingesta dietética; ácidos grasos saturados
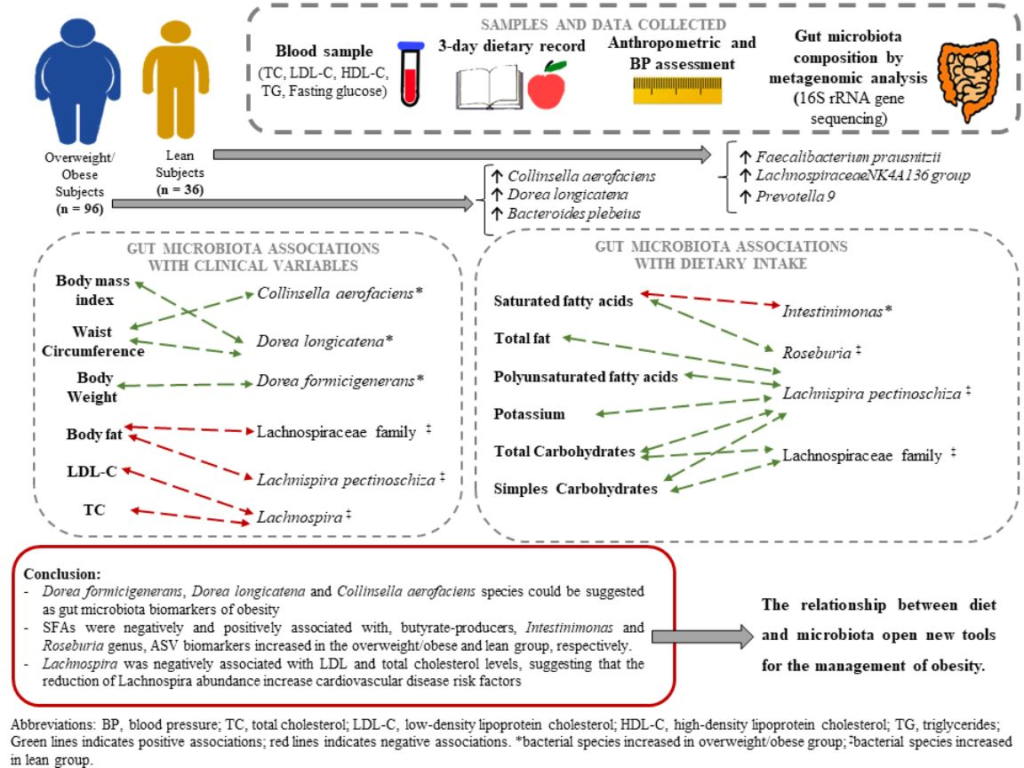
1. Introducción
La prevalencia mundial de la obesidad casi se ha triplicado desde 1975 [1]. La edad, los antecedentes familiares, la genética, el sexo, la raza y la etnia son factores de riesgo no modificables que influyen en la aparición de la obesidad, mientras que la dieta representa el principal factor de riesgo modificable para hacer frente a la incidencia de la obesidad [2].
Grupos específicos de alimentos o ciertos compuestos dietéticos, como el alto consumo de carnes rojas, ácidos grasos saturados (AGS) y la ingesta insuficiente de fibra, se han relacionado con la aparición y progresión de la obesidad [3,4,5].
Un enfoque para el tratamiento de la obesidad desarrollado en los últimos años consiste en un estudio de la microbiota intestinal, que da como resultado una descripción de las diferencias significativas entre la microbiota intestinal de los sujetos delgados y la de los obesos. Por ejemplo, un aumento de la proporción Bacteroidetes/Firmicutes en el intestino se ha asociado con el desarrollo de obesidad en sujetos obesos [6]. Además, se ha observado una menor diversidad microbiana en sujetos obesos en comparación con sujetos delgados [6]. En este contexto, pocas variables antropométricas, como la acumulación de grasa visceral y la circunferencia de la cintura (CC), están relacionadas con la microbiota intestinal. Por ejemplo, se ha encontrado una asociación inversa entre la presencia del género Blautia y la acumulación de grasa visceral en adultos japoneses [7], mientras que se ha encontrado una asociación positiva entre la presencia del género Acidaminococcus y el índice de masa corporal (IMC), la CC y las circunferencias de la cadera en adultos bangladesíes [8].
Además, la ingesta dietética se considera un modulador de la microbiota intestinal en sujetos obesos. Por ejemplo, una ingesta elevada de grasas y AGS, como se observó en ensayos controlados aleatorizados, puede reducir la riqueza y diversidad de la microbiota intestinal [5], mientras que una ingesta elevada de proteínas, como se observó en estudios observacionales, se correlaciona con altas concentraciones de Bacteroidetes, un filo relacionado con la pérdida de peso, en el microbioma intestinal [9].
A pesar de que la evidencia disponible pone de relieve las características de la microbiota intestinal en sujetos obesos, la información sobre la asociación entre las variables clínicas relacionadas con la obesidad y la ingesta dietética y la microbiota intestinal en humanos sigue siendo escasa.
La hipótesis investigada en el presente estudio es que las variables clínicas y la ingesta dietética se asocian con diferentes composiciones de la microbiota intestinal tanto en sujetos con sobrepeso/obesidad como en sujetos delgados. Por lo tanto, en el presente estudio transversal, nuestro objetivo fue diferenciar la microbiota intestinal de los sujetos con sobrepeso/obesidad de la de los sujetos delgados, y determinar su asociación con las variables clínicas y la ingesta dietética.
2. Materiales y métodos
2.1. Diseño del estudio y participantes
Se realizó un estudio transversal con dos poblaciones diferentes: (1) 96 sujetos con sobrepeso/obesidad (índice de masa corporal [IMC] ≥ 25 kg/m2 y ≤35 kg/m2) y (2) 32 sujetos delgados (IMC < 25 kg/m2). Todos los sujetos fueron reclutados entre junio de 2016 y diciembre de 2018 en Reus y su periferia (España), y todas las visitas de estudio se realizaron en Eurecat, Centre Tecnològic de Catalunya, Unitat de Nutrició i Salut.
Los criterios de inclusión fueron: (1) grupo obeso, >18 años de edad, obesidad abdominal (CC ≥ 88 cm en mujeres y ≥102 cm en hombres) y consentimiento informado firmado; y (2) grupo delgado, >18 años de edad, IMC ≤ 25 kg/m2 y consentimiento informado firmado.
Los criterios de exclusión fueron: uso de antibióticos en los 30 días previos al estudio; sujetos que padecen diabetes, enfermedades crónicas gastrointestinales o anemia (hemoglobina: <13 g/dL en hombres; <12 g/dL en mujeres); IMC < 18 kg/m2 y >40 kg/m2; mujeres embarazadas o en período de lactancia; sujetos que han seguido recientemente una dieta hipocalórica o un tratamiento farmacoterapéutico para adelgazar; y sujetos que participaron en un ensayo clínico o estudio de intervención nutricional en los 30 días anteriores a la inclusión en el estudio.
Todos los sujetos firmaron un consentimiento informado previo a su participación en el estudio, que fue aprobado antes del inicio del periodo de estudio por el Comité Ético de Investigación Clínica del HUSJ, Reus, España. Los protocolos y ensayos se llevaron a cabo de acuerdo con la Declaración de Helsinki y las Guías de Buenas Prácticas Clínicas de la Conferencia Internacional de Armonización (ICH GCP) y se informaron como STROBE-nut: Una extensión de la declaración STROBE para la epidemiología nutricional [10].
2.2. Parámetros clínicos
2.2.1. Medidas antropométricas
Todos los parámetros fueron medidos por dietistas capacitados en la visita inicial. Los datos antropométricos se obtuvieron con los sujetos sin zapatos. El CC se midió en el ombligo con una cinta métrica antropométrica de acero de 150 cm. El peso corporal, la masa grasa, la masa magra, la masa muscular, la masa ósea y el agua total se midieron con una báscula portátil TANITA SC 330 S (Peroxfarma, Barcelona, España). La talla se midió con una Tanita Leicester Portable (Tanita Corp., Barcelona, España), y el IMC se calculó como el cociente entre el peso medido (kg) y el cuadrado de la altura (m).
2.2.2. Mediciones de la presión arterial
En la visita inicial, la presión arterial sistólica (PAS) y la presión arterial diastólica (PAD) fueron medidas por médicos capacitados dos veces, a intervalos de 1 minuto entre mediciones. Los valores medios de presión arterial se registraron mediante un esfigmomanómetro automático (OMRON HEM-907; Peroxfarma, Barcelona, España) mientras se acompaña a los voluntarios en posición sentada.
2.2.3. Perfil lipídico y medición de glucosa
Las concentraciones de colesterol total, colesterol de lipoproteínas de alta densidad (HDL), triglicéridos y glucosa en suero se midieron mediante métodos enzimáticos automatizados estandarizados con un autoanalizador (Beckman Coulter-Synchron, Galway, Irlanda) en la visita inicial. El nivel de colesterol de lipoproteínas de baja densidad (LDL) se calculó con la fórmula de Friedewald.
2.3. Ingesta dietética
Los voluntarios registraron un registro de ingesta dietética de tres días dentro de 1 semana antes de la visita del estudio (incluidos dos días laborables y un día de fin de semana). Los voluntarios recibieron instrucciones sobre cómo registrar su ingesta dietética. En la visita inicial, los dietistas verificaron el registro dietético junto con los voluntarios y verificaron las cantidades faltantes de productos utilizando PortBook para completar cualquier información faltante [11]. La ingesta media diaria de energía y nutrientes se calculó a partir de las Tablas Españolas de Composición de Alimentos utilizando un software informatizado (PCN Pro 1.0).
2.4. Recogida de muestras fecales
En la visita inicial, los voluntarios recibieron un dispositivo de recolección de heces ProtocultTM (ABC, Minnesota, EEUU) para proporcionar una muestra fecal. Se pidió a los sujetos que recogieran la muestra fecal a más tardar 72 h antes de la visita basal en un recipiente estéril con 10 mL de solución de almacenamiento de RNAlater (Sigma-Aldrich Química SL; Madrid, España) y se les indicó que posteriormente almacenaran la muestra en el congelador hasta la visita inicial. Después de la entrega a los investigadores, las muestras de heces se almacenaron inmediatamente a -80 °C hasta la extracción del ADN.
2.5. Tamaño de la muestra
El tamaño de la muestra se estimó a partir de un estudio [12], que encontró diferencias significativas en la composición de la microbiota intestinal entre tres sujetos delgados y cuatro obesos, y de otro estudio [13], que encontró diferencias significativas en la composición de la microbiota intestinal entre 27 sujetos delgados y 26 sujetos con sobrepeso/obesidad.
Por lo tanto, asumimos que un tamaño de muestra ampliado de 32 sujetos en el grupo delgado y 96 en el grupo obeso era suficiente para lograr una potencia significativa.
2.6. Análisis de la microbiota fecal
2.6.1. Purificación y secuenciación del ADN
Las muestras fecales almacenadas en RNAlater® se diluyeron con solución de PBS (dilución 1:2) y se centrifugaron a 2000 rpm y 4 °C durante 5 min. Se utilizó una estación de trabajo robótica, MagNA Pure LC Instrument (Roche), de acuerdo con las instrucciones del fabricante para la extracción de ADN total de células bacterianas peletizadas con el kit de aislamiento de ADN MagNA Pure LC III (Bacterias, Hongos) (Roche). La región V3-V4 del gen 16S rRNA se amplificó mediante PCR con los cebadores: el cebador directo (5′-TCGT CGGC AGCG TCAG ATGT GTAT AAGA GACA GCCT ACGG GNGG CWGCAG-3′) y el cebador inverso (5′-GTCT CGTG GGCT CGGA GATG TGTA TAAG AGAC AGGA CTAC HVGG GTAT CTAA TCC-3′). Esta región se utilizó para la construcción de la biblioteca de amplicones de acuerdo con las instrucciones de Illumina. La secuenciación se realizó con Kit V3 (2 × 300 ciclos) en una plataforma MiSeq (Illumina, Eindhoven, Países Bajos) en el Centro de Investigación en Salud Pública (FISABIO-Salud Pública, Valencia, España). Todas las secuencias se han depositado en la base de datos EBI con los números de acceso PRJEB36385 y PRJEB32411.
2.6.2. Análisis de la microbiota fecal: análisis de la secuencia
Se aplicó Prinseq (v0.20.4) [14] para recortar los extremos de cada lectura con bases con una calidad inferior a 30 y descartar lecturas inferiores a 100 bases. Los siguientes pasos se realizaron con R (v3.6.0) [15] utilizando las funciones correspondientes de la biblioteca DADA2 (v1.8.0) [16]. La dereplicación se realizó para combinar todas las lecturas idénticas en secuencias únicas con una abundancia igual al número de lecturas combinadas. Con base en las lecturas dereplicadas y las estimaciones de errores, se inferieron variantes de secuencia de amplicones (ASV). Los ASV se alinearon utilizando Bowtie2 contra el genoma humano (GRCh38.p11) y posteriormente se descartaron las coincidencias [17]. La anotación taxonómica de los ASV se obtuvo utilizando la base de datos Silva (versión 123). Para asignar una especie única a cada secuencia de ASV, se buscó un 100% de coincidencias de similitud. Además, los ASV con un género asignado pero sin coincidencia exacta a nivel de especie se alinearon con BLAST [18] utilizando la misma base de datos de referencia con una identidad mínima del 97%.
Los parámetros de diversidad alfa, el índice de diversidad de Shannon y el estimador de riqueza Chao1 se calcularon utilizando la biblioteca vegana en el paquete R. Las diferencias estructurales entre comunidades (diversidad beta) se evaluaron mediante análisis de coordenadas principales (PCoA) basado en el índice de disimilitud de Bray-Curtis. Para determinar la contribución de un factor ambiental a la variabilidad de la composición de la microbiota entre los grupos, realizamos el test ADONIS utilizando el paquete R.
2.7. Análisis estadístico
Los datos descriptivos se expresan como medias ± desviaciones estándar (DE) y los datos categóricos se expresan como porcentajes. La significación estadística se definió como un valor de p < 0,05.
El análisis estadístico de las características clínicas basales y las comparaciones entre los grupos se realizaron utilizando el software IBM SPSS Statistics versión 23.0 (SPSS Inc., Chicago, IL, EE.UU.).
La normalidad de las variables se evaluó mediante las pruebas de Kolmogorov-Smirnov y Shapiro Wilk. Se utilizó la prueba t de Student para las comparaciones de variables distribuidas normalmente, y la prueba de suma de rangos de Wilcoxon para las variables no distribuidas normalmente. Las diferencias en las variables categóricas se examinaron mediante análisis de chi-cuadrado. Las diferencias en las variables continuas con distribuciones paramétricas y no paramétricas se examinaron mediante la prueba t de Student y la prueba U de Mann-Whitney, respectivamente.
Se utilizó un algoritmo de análisis discriminante lineal (LDA) del tamaño del efecto (LEfSe) para la detección de biomarcadores de ASV. El valor de α se fijó en <0,05 y el umbral utilizado para considerar una característica discriminativa para la puntuación logarítmica de LDA se fijó en >2,5 o >3,0. También se realizó una prueba de suma de rangos de Wilcoxon con los datos composicionales de los grupos de sobrepeso/obesidad y delgados.
Las asociaciones entre la energía, los nutrientes dietéticos o las variables clínicas y la composición de la microbiota se evaluaron a partir de biomarcadores de ASV que mostraron una abundancia diferencial significativa basada en un análisis de mínimos cuadrados parciales dispersos (sPLS), que es un método multivariante descrito por Best y Roberts (1975) [19] e implementado en el paquete R ‘mixOmics’ [20]. Se utilizó sPLS con ncomp = 3 y 20 variables (para asociación de datos clínicos) o 30 variables (para asociaciones de dieta) por componente (KeepX) y se aplicó un modo canónico porque este método modela relaciones bidireccionales (no causales) entre dos conjuntos de datos. El producto interno de las coordenadas de cada variable se aproxima a su puntuación de asociación. Este umbral se estableció en 0,5 para representar las relaciones en las redes.
3. Resultados
3.1. Características basales de los participantes
En este caso, 128 sujetos fueron incluidos en el presente estudio transversal. Las características basales de los sujetos se presentan en la Tabla 1.
Tabla 1. Características generales de los sujetos con sobrepeso/obesidad y delgados incluidos en el estudio transversal.
Tabla 1. Características generales de los sujetos con sobrepeso/obesidad y delgados incluidos en el estudio transversal.
| Características | Sujetos con sobrepeso y obesidad (n = 96) | Asignaturas Lean (n = 32) | p Valor |
|---|---|---|---|
| Edad, y | 52.2 ± 9.7 | 40.2 ± 8.9 | <0,001 |
| Mujeres, % | 38.5 | 50.0 | 0.254 |
| Presión arterial sistólica, mm Hg | 129.8 ± 15.9 | 109.7 ± 7.1 | <0,001 |
| Presión arterial diastólica, mm Hg | 81.1 ± 9.6 | 65.8 ± 5.9 | <0,001 |
| Presión de pulso, mm Hg | 68.4 ± 8.8 | 43.8 ± 6.8 | <0,001 |
| Actividad Física, % | 0.180 | ||
| Inactivo | 7.3 | 0.0 | |
| Actividad muy baja | 3.1 | 10.0 | |
| Baja actividad | 14.6 | 6.7 | |
| Actividad moderada | 20.8 | 20.0 | |
| Alta actividad | 54.2 | 63.3 | |
| Parámetros antropométricos | |||
| Índice de masa corporal, kg/m2 | 31.2 ± 3.4 | 23.9 ± 2.6 | <0,001 |
| Circunferencia de la cintura, cm | |||
| Masculino | 111.2 ± 8.1 | 87.7 ± 6.6 | <0,001 |
| Hembra | 99.3 ± 7.6 | 80.5 ± 9.7 | <0,001 |
| Masa grasa, % | 34.9 ± 8.3 | 22.3 ± 8.1 | <0,001 |
| Masa grasa, kg | 30.6 ± 7.8 | 14.9 ± 6.3 | <0,001 |
| Masa magra, kg | 58.0 ± 13.8 | 53.6 ± 11.0 | 0.146 |
| Masa muscular, kg | 55.1 ± 13.1 | 50.9 ± 10.5 | 0.157 |
| Masa ósea, kg | 2.8 ± 0.6 | 2.6 ± 0.5 | 0.162 |
| Agua total, % | 46.6 ± 6.4 | 55.1 ± 8.5 | <0,001 |
| Agua total, kg | 41.8 ± 10.3 | 37.8 ± 8.7 | 0.073 |
| Parámetros sanguíneos | |||
| Glucosa en ayunas, mg/dl | 94.5 ± 10.2 | 80.3 ± 7.2 | <0,001 |
| Colesterol total, mg/dl | 205.1 ± 30.8 | 179.6 ± 34.6 | <0,001 |
| Colesterol LDL, mg/dl | 127.4 ± 26.3 | 99.4 ± 33.5 | <0,001 |
| Colesterol HDL, mg/dl | 52.7 ± 13.0 | 63.1 ± 17.6 | 0.001 |
| Triglicéridos, mg/dl | 125.3 ± 56.8 | 85.5 ± 43.0 | <0,001 |
Abreviaturas: LDL, lipoproteína de baja densidad; HDL: lipoproteína de alta densidad. Los datos son media ± DE (desviación estándar), a menos que se indique lo contrario.
Las diferencias en las variables categóricas se examinaron mediante análisis de chi-cuadrado y se presentaron como porcentaje (%). Las diferencias en las variables continuas se examinaron utilizando T-Student para las variables paramétricas y U el Mann-Whitney para las variables no paramétricas. La significación estadística se fijó en p valor < 0,05.
El grupo de sobrepeso/obesidad estuvo formado por 96 sujetos (61,5% hombres y 38,5% mujeres) con una edad media de 52,2 ± 9,7 años. El grupo delgado estuvo formado por 32 sujetos (50% hombres y 50% mujeres) con una edad media (± DE) de 40,2 ± 8,9 años. No se observaron diferencias significativas de género entre los grupos. A pesar de que hubo diferencias significativas de edad entre los dos grupos, el grupo con sobrepeso/obesidad fue mayor que el grupo delgado (p < 0,001), ambos grupos se encontraban en el mismo rango de edad (adultez) y no se realizaron ajustes, ya que se ha demostrado que los sujetos entre 40 y 59 años (mediana edad) tienen una microbiota intestinal similar en comparación con los adultos jóvenes o adultos mayores [21].
El grupo con sobrepeso/obesidad presentó significativamente (p < 0,001) niveles más altos de diversos parámetros antropométricos que el grupo delgado: IMC, 31,2 ± 3,4 vs. 23,9 ± 2,6 kg/m2; CC en mujeres, 99,3 ± 7,6 vs. 80,5 ± 9,7 cm y en hombres, 111,2 ± 8,1 vs. 87,7 ± 6,6 cm; masa grasa, 34,9 ± 8,3 vs. 22,3 ± 8,1%; y el agua total, 46,6 ± 6,4 vs. 55,1 ± 8,5%. No se observaron diferencias significativas en la masa magra, la masa muscular o la masa ósea entre los grupos.
Además, el grupo con sobrepeso/obesidad presentó mayores niveles de PAS (129,8 ± 15,9 vs. 109,7 ± 7,1 mm Hg), PAD (81,1 mm). 1 ± 9,6 vs. 65,8 ± 5,9 mm Hg), glucosa en ayunas (94,5 ± 10,2 vs. 80,3 ± 7,2 mg/dL), colesterol total (205,1 ± 30,8 vs. 179,6 ± 34,6 mg/dL), colesterol LDL (127,4 ± 26,3 vs. 99,4 ± 33,5 mg/dL), colesterol HDL (52,7 ± 13,0 vs. 63,1 ± 17,6 mg/dL) y triglicéridos (125,3 ± 56,8 vs. 85,5 ± 43,0 mg/dL) que el grupo magro (p < 0,001).
No se encontraron diferencias significativas en la actividad física entre los grupos.
3.2. Evaluación dietética
Las características de la ingesta dietética de los sujetos en función de su registro dietético de 3 días se presentan en la Tabla 2.
Tabla 2. Características de la ingesta dietética de sujetos con sobrepeso/obesidad y delgados incluidos en el estudio transversal.
Tabla 2. Características de la ingesta dietética de sujetos con sobrepeso/obesidad y delgados incluidos en el estudio transversal.
| Energía, macro y micronutrientes | Grupo de sobrepeso y obesidad (n = 96) | Grupo Lean (n = 32) | p Valor |
|---|---|---|---|
| Energía, kcal/día | 2055.9 ± 604.3 | 2095.9 ± 502.8 | 0.184 |
| CHO, % de energía | 36.0 ± 6.3 | 39.9 ± 6.8 | 0.013 |
| FOR, gramos | 181.2 ± 60.9 | 206.0 ± 53.1 | 0.005 |
| CHO simple, % de energía | 15.5 ± 4.8 | 17.5 ± 4.1 | 0.043 |
| CHO simple, gramos | 78.3 ± 35.8 | 92.1 ± 35.9 | 0.014 |
| CHO complejo, % de energía | 20.6 ± 5.7 | 22.3 ± 5.1 | 0.301 |
| CHO complejo, gramos | 103.8 ± 41.9 | 113.8 ± 24.8 | 0.017 |
| Proteína, % de energía | 18.1 ± 4.3 | 17.6 ± 3.3 | 0.702 |
| Proteína, gramos | 90.07 ± 24.9 | 90.3 ± 22.9 | 0.369 |
| Grasa total, % de energía | 41.6 ± 5.6 | 40.0 ± 7.0 | 0.472 |
| Grasa total, gramos | 97.4 ± 34.5 | 95.0 ± 33.1 | 0.429 |
| SFA, % de energía | 12.4 ± 2.8 | 11.0 ± 2.7 | 0.083 |
| SFA, gramos | 29.6 ± 13.1 | 26.5 ± 10.8 | 0.515 |
| MUFA, % de energía | 19.0 ± 3.2 | 19.0 ± 4.5 | 0.506 |
| MUFA, gramos | 44.0 ± 15.0 | 45.3 ± 17.7 | 0.162 |
| PUFA, % de energía | 6.6 ± 2.0 | 6.6 ± 1.8 | 0.710 |
| PUFA, gramos | 15.6 ± 7.4 | 15.6 ± 6.0 | 0.247 |
| Fibra, g/día | 18.8 ± 6.8 | 23.7 ± 9.1 | <0,001 |
| Alcohol, g/día | 12.9 ± 18.8 | 7.4 ± 9.2 | 0.327 |
| Colesterol dietético, mg/día | 391,8 ± 188,5 | 341,1 ± 164,4 | 0.259 |
| Sodio, mg/día | 2580.8 ± 928.6 | 2353.2 ± 728.1 | 0.485 |
| Potasio, mg/día | 3042.4 ± 868.5 | 3448.3 ± 826.2 | 0.002 |
| Calcio, mg/día | 752,9 ± 354,2 | 789,3 ± 339,9 | 0.549 |
| Magnesio, mg/día | 309,5 ± 106,9 | 345.2 ± 74.0 | 0.001 |
CHO, hidratos de carbono; SFA, ácidos grasos saturados; MUFA: ácidos grasos monoinsaturados; PUFA, ácidos grasos poliinsaturados. Datos expresados como media ± desviación estándar. Las diferencias en las variables categóricas se examinaron mediante análisis de chi-cuadrado y se presentaron como porcentaje (%). Las diferencias en las variables continuas se examinaron utilizando T-Student para las variables paramétricas y U de Mann-Whitney para las variables no paramétricas. La significación estadística se estableció en p Valor < 0,05.
Ambos grupos presentaron una ingesta media similar, sin diferencias significativas en la ingesta energética total y en la ingesta de proteínas, grasas totales, AGS, ácidos grasos monoinsaturados, ácidos grasos poliinsaturados (AGPI), alcohol, colesterol dietético, sodio y calcio. Sin embargo, el grupo con sobrepeso/obesidad consumió un promedio diario más bajo de carbohidratos totales (media ± DE) 206,0 ± 53,1 vs. 181,2 ± 60,9 g; p = 0,005, carbohidratos simples 92,1 ± 35,9 vs. 78,3 ± 35,8 g; p = 0,014, carbohidratos complejos 113,8 ± 24,8 vs. 103,8 ± 41,9 g; p = 0,017, fibra 23,7 ± 9,1 vs. 18,8 ± 6,8 g; p < 0,001, potasio 3042,4 ± 868,5 vs. 3448,3 ± 826,2 mg; p = 0,002 y magnesio 309,5 ± 106,9 vs. 345,2 ± 74,0 mg; p = 0,001 que el grupo magro.
3.3. Análisis de la composición de la microbiota intestinal
Se realizaron comparaciones entre los grupos a nivel de filo (Figura Suplementaria S1). Los dos principales filos en los grupos de sobrepeso/obesidad y delgados fueron Firmicutes (60,44% y 57,61%, respectivamente) y Bacteroidetes (29,93% y 35,23%, respectivamente). El grupo con sobrepeso/obesidad tuvo abundancias significativamente mayores de los filos Actinobacteria (Bacteria), Firmicutes (Bacteria) y Euryarchaeota (Archaea) (p = 5.5 × 10 −5, p = 0.056 y p = 0.00091, respectivamente) y abundancias significativamente menores de los filos Tenericutes, Lentisphaerae y Bacteroidetes (p = 0.00096, p = 0.013 y p = 0,021, respectivamente) que el grupo magro. Como resultado, la relación Firmicutes/Bacteroidetes en el grupo de sobrepeso/obesidad fue mayor que en el grupo delgado.
La asignación taxonómica se realizó a nivel de género (Figura 1a). Los principales géneros en los grupos de sobrepeso/obesidad y magro fueron los siguientes: a) Firmicutes phylum, Faecalibacterium (12,64% y 12,78%, respectivamente), Agathobacter (4,72% y 4,08%, respectivamente), Subdoligranulum (3,02% y 1,73%, respectivamente), Ruminococcus 2 (2,70% y 1,39%, respectivamente), Phascolarctobacterium (2,39% y 2,77%, respectivamente) y Ruminococcus 1 (2,06% y 2,45%, respectivamente); y b) Bacteroidetes phylum, Bacteroides (14,45% y 17,82%, respectivamente), Prevotella 9 (7,77% y 8,71%, respectivamente) y Parabacteroides (2,08% y 2,05%, respectivamente). No se encontraron diferencias significativas en los principales géneros entre los grupos.


Figura 1. a) Composición taxonómica a nivel de género encontrada para cada grupo. El eje X representa el grupo (grupos con sobrepeso/obesidad y delgados), y el eje Y representa la abundancia relativa asignada a cada género. b) Diferencias en la diversidad (índice de Shannon) entre los grupos obesos y delgados. (c) Diferencias en la riqueza (estimador de riqueza de Chao 1) entre los grupos de sobrepeso/obesidad y delgados. d) Diferencia en la distribución y variabilidad de la estructura de la microbiota determinada por el análisis de coordenadas principales (PCoA) basado en el índice de disimilitud de Bray-Curtis.
Las mediciones de diversidad obesas obesas y de los grupos de sobrepeso/obesidad y delgado a nivel de ASV mostraron diferencias no significativas, lo que indicó que el grupo de sobrepeso/obesidad tuvo un mayor índice de diversidad de Shannon (p = 0,066) (Figura 1b). Además, los resultados de la riqueza microbiota basados en el estimador de riqueza Chao1 mostraron una diferencia estadísticamente significativa entre los grupos (p = 0,033), lo que indicaba que la riqueza de la microbiota intestinal era significativamente menor en el grupo con sobrepeso/obesidad que en el grupo delgado (Figura 1c). Así, la microbiota del grupo con sobrepeso/obesidad presentó menos taxones bacterianos pero mayor uniformidad de especies. Por último, para evaluar la distribución y variabilidad de los perfiles de microbiota entre los dos grupos, se realizó un test de PCoA y se detectó una diferencia significativa en la estructura de la microbiota intestinal entre los dos grupos (PERMANOVA p = 0,00166) (Figura 1d).
Se realizó un análisis LEfSe de los grupos de sobrepeso/obesidad y delgado utilizando puntuaciones LDA > 2,5 y >3,0. Un total de 23 biomarcadores de ASV mostraron abundancias significativamente diferentes entre los dos grupos, con puntuaciones de LDA > 3. En este caso, 14 biomarcadores de ASV aumentaron en el grupo de sobrepeso/obesidad, y 19 biomarcadores de ASV en el grupo delgado, como se muestra en la Figura 2 y en la Tabla Suplementaria S1.

Figura 2. Análisis LEfSe entre los grupos de sobrepeso/obesidad (verde) y delgado (rojo) (puntuación LDA > 3,0). La puntuación LDA (log10) para el ASV más prevalente en el grupo de sobrepeso/obesidad se representa en una escala positiva y la puntuación LDA para el ASV más prevalente en el grupo delgado se representa en una escala negativa.
De los 14 biomarcadores en el grupo de sobrepeso/obesidad, 10, dos y dos pertenecían a Firmicutes, Actinobacteria y Bacteroidetes, respectivamente. En el filo Firmicutes, las familias Lachnospiraceae (Dorea, Blautia, Coprococcus, Lachnospiraceae_ND3007_group, Fusicatenibacter y Agathobacter) y Ruminococcaceae (Faecalibacterium y Subdoligranulum) exhibieron la mayor abundancia en el grupo de obesos. Coriobacteriaceae (Collinsella) y Bifidobacteriaceae (Bifidobacterium), que pertenecen al filo Actinobacteria y Bacteroidaceae (Bacteroides) y Prevotellaceae (Prevotella NK3B31) del filo Bacteroidetes fueron las familias más enriquecidas en este grupo. Principalmente, los tres biomarcadores de ASV en el grupo de sobrepeso/obesidad con mayor poder de discriminación y mayor puntaje LDA > 3 fueron los ASV 0010, 0009 y 0048, que pertenecen a las especies Dorea longicatena, Collinsella aerofaciens y Bacteroides plebeius, respectivamente.
Por el contrario, 17, 13 y uno de los 31 biomarcadores detectados para el grupo delgado pertenecían a Firmicutes (Ruminococcaceae, Lachnospiraceae, Christensenellaceae y Veillonellaceae), Bacteroidetes (Bacteroidaceae, Prevotellaceae, Tannerellaceae y Marinifilaceae) y Tenericutes (Anaeroplasmataceae), respectivamente. Los cuatro biomarcadores de ASV en el grupo delgado con mayor poder de discriminación y mayor puntuación de LDA > 3 fueron ASV0024, ASV0037, ASV0122 y ASV0069, y se identificaron como Faecalibacterium prausnitzii, Lachnospiraceae NK4A136 grupo, Prevotella 9 y Christensenellaceae R-7, respectivamente.
3.3.1. Asociaciones entre variables clínicas y la microbiota intestinal
Se evaluaron las asociaciones entre los ASV con la abundancia diferencial y las variables clínicas a través de un análisis multivariable de sPLS. Tres biomarcadores, Collinsella aerofaciens, Dorea longicatena y Dorea formicigenerans, que fueron más abundantes en el grupo de sobrepeso/obesidad, presentaron asociaciones positivas con variables antropométricas: (a) la CC exhibió asociaciones positivas con la abundancia de Collinsella aerofaciens y Dorea longicatena; (b) el IMC mostró una asociación positiva con Dorea longicatena; y (c) el peso corporal se asoció positivamente con Dorea formicigenerans (Figura 3a). La grasa corporal fue la única variable antropométrica con asociación negativa con cinco biomarcadores del grupo magro: Lachnospiraceae NK4A136 grupo (ASV0037), Lachnospiraceae NK4A136 grupo (ASV0068), Lachnospiraceae GCA-900066575, miembro de la familia Lachnospiraceae (ASV0246) y Lachnospira pectinoschiza (Figura 3a).

Figura 3. Asociaciones relevantes a nivel de ASV detectadas por sPLS. (a) Correlaciones relevantes para las variables antropométricas y el perfil lipídico con los ASV que muestran la mayor diferencia entre los grupos de sobrepeso/obesidad y delgado. (b) Asociaciones relevantes entre las variables de ingesta dietética y los ASV que muestran la mayor diferencia entre los grupos de sobrepeso/obesidad y delgados. Las burbujas verdes muestran los biomarcadores de ASV que aumentaron significativamente en el grupo de sobrepeso/obesidad, y las burbujas rojas muestran biomarcadores de ASV que aumentaron significativamente en el grupo delgado; De acuerdo con el código de clave Color, las asociaciones positivas y negativas se relacionaron con los colores de línea: los colores morado, rojo, naranja y amarillo indicaron asociaciones positivas (de mayor a menor índice de correlación); Los colores azul y verde indicaron asociaciones negativas (de mayor a menor índice de correlación).
Además, el género Lachnospira, que se encontró en mayor abundancia en el grupo delgado que en el grupo con sobrepeso/obesidad, también mostró asociaciones negativas con los niveles de colesterol total y colesterol LDL (Figura 3a).
No se encontraron asociaciones entre la microbiota intestinal y las siguientes variables clínicas: glucosa, colesterol HDL, triglicéridos, PAS y PAD.
3.3.2. Asociaciones entre la dieta y la microbiota intestinal
Determinamos las asociaciones entre los ASV diferencialmente abundantes y los datos de ingesta de energía y nutrientes a través de un análisis sPLS con un índice de asociación > 0,5 (Figura 3b). Los AGS se asociaron negativamente con Intestinimonas, un género que fue significativamente más abundante en el grupo de sobrepeso/obesidad, y los AGS también se asociaron positivamente con el género Roseburia, un biomarcador de ASV con mayor abundancia en el grupo delgado (Figura 3b). La ingesta total de grasas se asoció positivamente con un miembro de Lachnospiraceae (ASV0246) y Lachnospira pectinoschiza, que son biomarcadores del grupo magro (Figura 3b). Además, los carbohidratos simples y los carbohidratos totales se correlacionaron positivamente con el grupo Lachnospiraceae NK4A136 (ASV0068) y Lachnospira pectinoschiza, los cuales exhibieron mayor abundancia en el grupo magro (Figura 3b). La ingesta de grasas totales, AGS, AGPI, carbohidratos totales y simples y potasio se asoció positivamente con la especie Lachnospira pectinoschiza, un biomarcador de ASV con mayor abundancia en el grupo magro, y esta especie exhibe una relación más fuerte con la dieta, según se determinó a través de un análisis sPLS (|Índice de correlación r| > 0,5) (Figura 3b).
4. Discusión
Hasta donde sabemos, el presente estudio transversal proporciona una nueva visión de las relaciones entre las variables clínicas y la ingesta dietética y la microbiota intestinal en sujetos con sobrepeso/obesidad y delgados.
Los primeros estudios sobre el microbioma intestinal y la obesidad se realizaron en ratones, y los resultados indicaron un papel importante de la microbiota en la obesidad, como lo demuestra el hallazgo de que los ratones obesos exhiben una menor diversidad y una mayor proporción de la abundancia relativa de Firmicutes con respecto a la de Bacteroidetes que los ratones delgados [22]. Sin embargo, los estudios de cohortes en humanos han arrojado resultados contradictorios. El presente estudio reveló que la proporción de Firmicutes y Bacteroidetes fue mayor en el grupo de sobrepeso/obesidad que en el grupo delgado. Estos resultados son consistentes con los obtenidos por otros investigadores, que encontraron que la microbiota intestinal de sujetos delgados mostraba niveles más altos de Bacteroidetes y niveles más bajos de Firmicutes y detectaron resultados opuestos en sujetos obesos [6]. De hecho, diferentes estudios han propuesto que Firmicutes sería más eficaz en la extracción de energía y la absorción de calorías de los alimentos, lo que induciría un posterior aumento de peso corporal [6,22]. Por otra parte, los datos del presente estudio revelaron que la microbiota intestinal del grupo delgado presentaba una mayor riqueza que la del grupo con sobrepeso y obesidad. Nuestros resultados son consistentes con los obtenidos en otro estudio que encontró que los sujetos obesos exhiben una menor riqueza bacteriana que los sujetos no obesos [23]. De acuerdo con nuestros datos, un estudio transversal reveló que el grupo con sobrepeso/obesidad presentó mayor diversidad que el grupo delgado [24]. Por lo tanto, la menor riqueza y la mayor diversidad encontradas en los individuos con sobrepeso/obesidad sugerirían una microbiota marcadamente más homogénea, según los resultados del índice de Shannon.
Con el objetivo de identificar las diferencias distintivas entre los grupos delgados y los de sobrepeso/obesidad, el presente trabajo encontró que el grupo de sobrepeso/obesidad exhibió depleción de bacterias productoras de butirato, como Faecalibacterium prausnitzii y Lachnospiraceae NK4A136 grupo [25]. En particular, la especie Faecalibacterium prausnitzii ha sido descrita como una especie protectora contra la obesidad con efectos antiinflamatorios, pero se encuentra abundantemente en el intestino de sujetos delgados [26]. Curiosamente, el presente estudio proporciona la primera identificación del género Lachnospiraceae NK4A136 como un biomarcador ASV del estado delgado en humanos. En consecuencia, un estudio en ratones demostró que el género Lachnospiraceae NK4A136 ejerce efectos protectores y antiinflamatorios como potencial productor de butirato [8,25].
Por el contrario, las especies pertenecientes al filo Firmicutes que producen ácido butírico fueron sustituidas en el grupo de sobrepeso/obesidad por otros géneros pertenecientes al mismo filo, como Dorea, Blautia, Coprococcus o Subdoligranulum, que podrían dar otras proporciones de butirato, propionato y acetato. Además, Collinsella aerofaciens y Bifidobacterium, que han sido descritas como degradadoras de fibra y consumidoras de H2 y producen principalmente lactato y acetato, también aumentaron en el grupo de sobrepeso/obesidad [27]. Además, Bacteroides plebeius, que también es una especie discriminante para el grupo de sobrepeso/obesidad, también ha sido descrita como productora de propionato y acetato [27].
Diversos estudios realizados en los últimos años han señalado que el aumento del acetato ejerce un efecto inductor sobre la obesidad porque el ácido acético estimula la síntesis de ácidos grasos y colesterol, así como el almacenamiento de grasa [6].
Curiosamente, mostramos que los niveles de LDL y colesterol total fueron mayores en el grupo con sobrepeso/obesidad que en el grupo delgado y que los individuos con sobrepeso/obesidad presentaron una menor abundancia del género Lachnospira que en el grupo delgado. Además, el género Lachnospira es un productor de ácidos grasos de cadena corta (AGCC) [28], y se ha descrito una reducción en la abundancia de Lachnospira acompañada de aumento de peso en adultos con sobrepeso [28]. Además, el género Lachnospira exhibió una asociación negativa con la glucosa en sangre en ayunas en modelos de ratas diabéticas [29]. Por primera vez, nuestro trabajo relacionó negativamente el género Lachnospira con la concentración sérica de LDL-C, y nuestros resultados coincidieron con el hallazgo de que una reducción en la abundancia de Lachnospira se asocia con aumentos en los factores de riesgo de enfermedad cardiovascular.
Además de las principales diferencias entre los grupos delgados y los de sobrepeso/obesidad, el presente trabajo también encontró una fuerte asociación negativa entre la grasa corporal y la familia Lachnospiraceae y encontró una relación entre esta familia bacteriana y un estado delgado. Contrariamente a nuestros resultados, un estudio con heces humanas de voluntarios ghaneses mostró que los sujetos delgados exhibían una menor abundancia de la familia Lachnospiraceae que los sujetos obesos [30]. Además, se ha encontrado una asociación positiva entre la familia Lachnospiraceae y trastornos metabólicos, como la obesidad [31]. Estas asociaciones contradictorias podrían haberse debido a que diferentes especies pertenecientes al mismo género bacteriano podrían desempeñar papeles distintos en el complejo contexto de la obesidad.
Además, Collinsella aerofaciens, Dorea formicigenerans y Dorea longicatena, que son biomarcadores de sujetos con sobrepeso/obesidad, se asociaron positivamente con el peso corporal, la CC y el IMC. En consecuencia, como se ha propuesto, uno de los principales biomarcadores discriminantes del ASV para la obesidad es la especie Collinsella aerofaciens [32]. Apoyando nuestros resultados, se encontró previamente que Dorea longicatena estaba significativamente aumentada en sujetos obesos [33]. Por lo tanto, el presente estudio no solo describió la abundancia de biomarcadores de ASV en sujetos obesos, sino que también confirmó la asociación entre los parámetros antropométricos y los biomarcadores de ASV.
La degradación de los polisacáridos y la fermentación de los hidratos de carbono simples por parte de la microbiota intestinal se han estudiado ampliamente, pero los conocimientos sobre la implicación de las bacterias intestinales en el metabolismo de los ácidos grasos siguen siendo escasos. Curiosamente, la ingesta de AGS, grasa total y AGPI mostró correlaciones positivas con la familia Lachnospiraceae, específicamente Roseburia y Lachnospira, que son géneros que se encontraron aumentados en el grupo magro. Por el contrario, la ingesta de AGS se asoció negativamente con Intestinimonas, un género que aumentó en el grupo de sobrepeso/obesidad. Estudios recientes han revelado que los efectos sobre la salud de los alimentos no pueden predecirse por su contenido de ningún grupo de nutrientes, como los AGS, sin tener en cuenta la distribución general de macronutrientes. Diferentes alimentos relativamente ricos en AGS, como los lácteos enteros, la carne no procesada y el chocolate negro, tienen diferentes matrices complejas que no se asocian con un mayor riesgo de enfermedad cardiovascular [34]. Por lo tanto, nuestros resultados podrían explicarse por el consumo de AGS no relacionados con un mayor riesgo de enfermedad cardiovascular. Según nuestros resultados, el género Roseburia (perteneciente a la familia Lachnospiraceae) es un productor de propionato y butirato que aumenta el gasto energético, lo que sugiere una influencia en la reducción del peso corporal. Además, el género Roseburia también está relacionado con el mantenimiento de la salud intestinal y el sistema inmunológico, por ejemplo, la homeostasis de las células T y la producción de AGCC, y exhibe propiedades antiinflamatorias [35]. Por lo tanto, la correlación positiva entre la ingesta de AGS y el género Roseburia puede explicarse por el hecho de que los micronutrientes de AGS pueden aumentar la comunidad bacteriana de un género relacionada con la salud intestinal y el estado magro.
De manera similar a nuestros resultados, el género Intestinimonas, que también es productor de butirato, exhibe una abundancia reducida en sujetos adultos obesos [36]. Además, los intestinos de una muestra fecal pueden convertir la lisina en butirato y acetato cuando se cultivan en medio sintético, lo que sugiere que la proteína de la dieta podría ser una fuente de butirato en el colon humano, y su conversión por bacterias butirógenas como Intestinimonas podría proteger al huésped de metabolitos no deseados [37].
Hasta donde sabemos, este estudio proporciona la primera demostración de una relación inversa entre el género Intestinimonas y el consumo de AGS en sujetos con sobrepeso u obesidad. Esta nueva asociación entre la dieta y la microbiota intestinal debe confirmarse en futuros ECA.
Además, nuestros resultados mostraron que el consumo de grasas totales, carbohidratos totales y simples y potasio exhibió una asociación positiva con la familia Lachnospiraceae ASV 0246 y ASV 0037, que son biomarcadores de ASV que exhiben una mayor abundancia en el grupo magro. Además, los AGPI, los AGS, la grasa total y los carbohidratos simples y el potasio, entre otros marcadores, se correlacionaron significativamente positivamente con Lachnospira pectinoschiza spp., una especie que exhibió una mayor abundancia en el grupo magro. De acuerdo con nuestros resultados, un estudio transversal de sujetos delgados que evaluó las asociaciones entre la ingesta de grasas (validada por un cuestionario semicuantitativo de frecuencia alimentaria de 131 ítems) y la microbiota intestinal reveló una asociación positiva entre 21 especies diferentes de Lachnospiraceae y el consumo de AGPI n-3 [38]. Además, los efectos de la dieta sobre las bacterias intestinales mostraron que el consumo de azúcar aumentó la abundancia de la familia Lachnospiraceae en modelos de rata, independientemente del estado del IMC [39].
Los resultados del presente estudio destacan una relación significativamente positiva para los géneros Lachnospiraceae y en particular para la especie Lachnospira pectinoschiza con la grasa y los carbohidratos de la dieta en sujetos delgados, lo que sugiere que la dieta influye en la abundancia de Lachnospira y apoya las características magras de los sujetos. Por lo tanto, el presente trabajo proporciona una posible estrategia novedosa para una interacción entre la dieta (grasas dietéticas e hidratos de carbono) y la microbiota intestinal mediante el aumento de la especie Lachnospira pectinoschiza y el estado de peso corporal magro. Esta nueva estrategia dietética tendrá que ser verificada en futuros ECA.
Curiosamente, después de evaluar todas las asociaciones, la familia Lachnospiraceae parece exhibir un vínculo entre la ingesta dietética y las variables clínicas. Como se mencionó anteriormente, la familia Lachnospiraceae incluye muchos géneros y bacterias diferentes y, por lo tanto, los autores pueden identificar más fácilmente esta relación que sacar conclusiones precisas.
Algunos de los puntos fuertes de este estudio son que se utilizó un modelo multivariante (sPLS) que tiene en cuenta más variables, como la microbiota intestinal, que está compuesta por muchas bacterias que interactúan entre sí, que las correlaciones de Spearman, que solo analizaron la relación de una variable con otra. Como resultado, hasta donde sabemos, mostramos por primera vez una nueva asociación entre las variables clínicas y la microbiota intestinal.
El presente trabajo tiene algunas limitaciones: el tamaño muestral del estudio fue pequeño y el diseño observacional del estudio no permite estudiar la interferencia causal de los resultados dietéticos presentados. La ingesta dietética extraída de los resultados se ha evaluado utilizando el método más preciso (registro dietético de 3 días), proporcionando información sobre la ingesta dietética de los 3 días previos a la recogida de muestras biológicas (fecales y sangre) de cada sujeto. Por lo tanto, 3 días es un tiempo corto y muy cercano a los resultados de la microbiota fecal, debido a que la microbiota intestinal es sensible a la dieta y puede cambiar rápidamente [40]. Sin embargo, las asociaciones relacionadas con la obesidad, la microbiota intestinal y la dieta pueden estar relacionadas con los resultados de las variaciones de la dieta, y los resultados en este sentido deben tomarse con precaución.
5. Conclusiones
En conclusión, el presente trabajo proporciona asociaciones importantes de la microbiota intestinal con las variables clínicas y la ingesta dietética. El peso corporal, el CC y el IMC mostraron una asociación positiva con Dorea formicigenerans, Dorea longicatena y Collinsella aerofaciens, que se identificaron como biomarcadores de ASV con mayor abundancia en el grupo de sobrepeso/obesidad y son especies que podrían considerarse biomarcadores de obesidad en la microbiota. Se observó una asociación negativa entre la grasa corporal o los niveles de LDL o colesterol total y la familia Lachnospiraceae, principalmente Lachnospira pectinoschiza, lo que sugiere que una reducción en la abundancia de Lachnospira aumenta los factores de riesgo de enfermedad cardiovascular lipídica. A diferencia de los resultados obtenidos para el IMC de los sujetos, se encontró que el consumo de AGS se asoció con productores de butirato bacteriano, se asoció negativamente con el género Intestinimonas y los biomarcadores del ASV en el grupo de sobrepeso/obesidad y se asoció positivamente con los biomarcadores del género Roseburia y ASV en el grupo delgado. Por lo tanto, la relación entre la dieta y la microbiota intestinal abre nuevas oportunidades para el tratamiento de la obesidad. Además, los resultados del presente trabajo deben tomarse con cautela, ya que son asociaciones obtenidas a través de un estudio observacional y no pueden mostrar efectos o mecanismos de acción porque se necesitarían ECA. Se requieren más estudios para confirmar los resultados actuales.
Materiales complementarios
Los siguientes están disponibles en línea en https://www.mdpi.com/article/10.3390/nu13062032/s1, Figura S1: Comparación a nivel de filo. Se muestran las diferencias significativas en la microbiota intestinal entre los grupos de sobrepeso/obesidad y delgados, Tabla S1: Diferencias significativas entre los grupos de sobrepeso/obesidad y delgados encontradas para la abundancia relativa de ASV que presentaron puntuaciones LDA > 2,5 en el análisis LEfSe.

