Stojanov, S.; Berlec, A.; Štrukelj, B. Influencia de los probióticos en la relación Firmicutes/Bacteroidetes en el tratamiento de la obesidad y la enfermedad inflamatoria intestinal. Microorganismos 2020, 8, 1715. https://doi.org/10.3390/microorganisms8111715
Abstracto
Los dos filos bacterianos más importantes del tracto gastrointestinal, Firmicutes y Bacteroidetes, han ganado mucha atención en los últimos años. Se acepta ampliamente que la relación Firmicutes/Bacteroidetes (F/B) tiene una influencia importante en el mantenimiento de la homeostasis intestinal normal. El aumento o la disminución de la relación F/B se considera disbiosis, por lo que la primera suele observarse con la obesidad y la segunda con la enfermedad inflamatoria intestinal (EII). Los probióticos, como microorganismos vivos, pueden conferir beneficios para la salud del huésped cuando se administran en cantidades adecuadas. Existe una evidencia considerable de sus propiedades nutricionales e inmunosupresoras, incluidos informes que dilucidan la asociación de los probióticos con la relación F/B, la obesidad y la EII. Los probióticos administrados por vía oral pueden contribuir a la restauración de la microbiota disbiótica y a la prevención de la obesidad o la EII. Sin embargo, como los efectos de los diferentes probióticos en la relación F/B difieren, la selección de la especie o mezcla adecuada es crucial. Los probióticos más comúnmente probados para modificar la relación F/B y tratar la obesidad y la EII son del género Lactobacillus. En este artículo, revisamos los efectos de los probióticos en la relación F/B que conducen a la pérdida de peso o la inmunosupresión.
Palabras clave:
probióticos; Firmicutes; Bacteroidetes; disbiosis; obesidad; inflamación
Resumen gráfico
1. Introducción
En el cuerpo humano, billones de microorganismos viven en simbiosis con el huésped y se encuentran principalmente en el tracto gastrointestinal, la piel, la saliva, la mucosa oral, la conjuntiva y la vagina [1]. Los microorganismos que habitan en el tracto gastrointestinal (es decir, la microbiota intestinal) son aproximadamente 1 × 1014 [2] y desempeñan un papel esencial en la homeostasis intestinal, el desarrollo y la protección contra los patógenos. Además, su presencia en el intestino se asocia con reacciones inmunomoduladoras y metabólicas [3]. La microbiota intestinal está formada por bacterias, levaduras y virus. Las bacterias en el intestino están representadas por más de 1000 especies que pertenecen a seis filos dominantes: Firmicutes, Bacteroidetes, Actinobacteria, Proteobacteria, Fusobacteria y Verrucomicrobia. Las bacterias de los filos Firmicutes y Bacteroidetes son las más comunes, representando el 90% de la microbiota intestinal [4]. La microbiota intestinal de un individuo sano difiere en diferentes partes del tracto gastrointestinal y cambia con el tiempo debido al envejecimiento (incluido el desarrollo infantil) y a factores ambientales como los hábitos dietéticos, el estilo de vida y el consumo de antibióticos. Existen grandes diferencias en la composición de la microbiota entre los individuos, y las diferencias se atribuyen a la edad, el origen étnico, el estilo de vida y la dieta [4,5]. Las diferentes microbiotas se clasifican en tres enterotipos distintos [6]. Estas variaciones se consideran fisiológicas y coherentes con una microbiota sana. Sin embargo, los cambios en la composición de la microbiota suelen estar relacionados con enfermedades, también denominadas disbiosis. Sin embargo, la causalidad entre la microbiota alterada y diversas enfermedades a menudo no está clara.
Para simplificar un poco la compleja cuestión de la composición de la microbiota, la presente revisión solo abordó los dos principales filos bacterianos del tracto gastrointestinal: Firmicutes y Bacteroidetes. La relación entre estos dos filos (la relación Firmicutes/Bacteroidetes (F/B)) se ha asociado con el mantenimiento de la homeostasis, y los cambios en esta relación pueden conducir a diversas patologías. Por ejemplo, los aumentos en la abundancia de especies específicas de Firmicutes o Bacteroidetes conducen a la obesidad y la inflamación intestinal, respectivamente [7,8]. El filo Firmicutes incluye bacterias grampositivas con paredes celulares rígidas o semirrígidas que son predominantemente de los géneros Bacillus, Clostridium, Enterococcus, Lactobacillus y Ruminicoccus [4,9], mientras que el filo Bacteroidetes incluye aproximadamente 7000 especies diferentes de bacterias gramnegativas que son predominantemente de los géneros Bacteroides, Alistipes, Parabacteroidesy Prevotella [10]. Aunque se presta mucha atención a la relación F/B, hay que tener en cuenta que esta relación puede verse afectada por un aumento en otros filos y que los aumentos disbióticos en otros filos no cambian necesariamente la relación F/B. Se demostró que el filo más variable es Proteobacteria, que contribuye a la disbiosis [11] y se correlaciona con una disminución de Firmicutes y diversidad microbiana general en la enfermedad inflamatoria intestinal (EII) [12].
El equilibrio del ecosistema intestinal es un aspecto importante para mantener la función normal del cuerpo humano, y muchas estrategias terapéuticas están diseñadas para lograr una relación F/B adecuada. La administración de probióticos, prebióticos, simbióticos, terapia con fagos, trasplante fecal y trasplante de consorcio bacteriano se han probado como métodos para modular la microbiota intestinal [13]. Por lo tanto, la presente revisión también se centra en el uso de probióticos para equilibrar la relación F/B y, en consecuencia, tratar la obesidad y la EII.
Según la definición de la OMS, los probióticos son microorganismos vivos que pueden conferir beneficios para la salud del huésped cuando se administran en cantidades adecuadas. Al modificar la microbiota, los probióticos pueden tratar varias enfermedades [14] y ejercer efectos antiobesidad y antiinflamatorios [7]. Como se ilustra en la Figura 1, los probióticos contribuyen a la alteración de la relación F/B, influyendo así en la obesidad del huésped o en la inflamación intestinal. El objetivo de esta revisión fue dilucidar los efectos de diferentes especies de probióticos sobre la obesidad y la inflamación, así como su relación con la relación F/B.
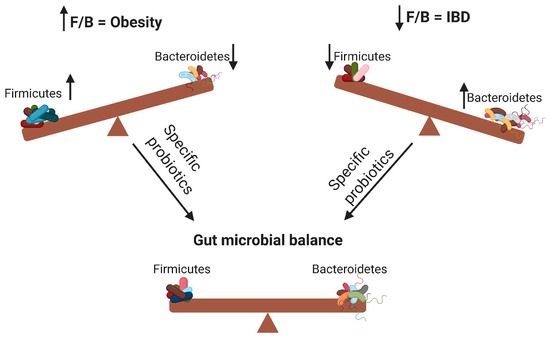
Figura 1. Los cambios en la relación Firmicutes/Bacteroidetes (F/B) pueden causar obesidad o enfermedad inflamatoria intestinal. Los probióticos específicos pueden restaurar el equilibrio microbiano intestinal al influir en la relación F/B. ↑ significa aumento; ↓ significa disminución.
2. El papel de la microbiota intestinal en la nutrición y la obesidad
La microbiota intestinal desempeña un papel esencial en la digestión de los alimentos debido a la presencia de genes, que codifican enzimas digestivas que no están presentes en las células humanas, pero que están asociadas con el metabolismo y la fermentación de varios compuestos alimentarios que presentan beneficios nutricionales para el huésped. Los productos metabólicos más abundantes de la microbiota intestinal son los ácidos grasos de cadena corta (AGCC), principalmente acetato, propionato y butirato, que se producen por fermentación anaeróbica de carbohidratos no digeridos [15]. La microbiota intestinal también interviene en el metabolismo de compuestos farmacológicamente activos como los fitoestrógenos [16]. Además, la disbiosis de la microbiota intestinal puede dar lugar a varias patologías, como la diabetes y la obesidad [17].
La obesidad es un importante problema de salud pública que está aumentando a escala mundial debido al estilo de vida moderno. Se estima que para 2030, el 38% de la población adulta tendrá sobrepeso y el 20% será obesa [18]. La etiología de la obesidad es diversa y son muchos los factores que influyen en su desarrollo. La microbiota intestinal está implicada en la aparición de la obesidad a través de interacciones directas con órganos proximales o interacciones indirectas con órganos distantes a través de productos metabólicos (principalmente AGCC), incluida la comunicación con el hígado, el tejido adiposo y el cerebro [19]. Los AGCC juegan un papel crucial en el desarrollo de la obesidad. Interactúan con el tejido adiposo a través de dos receptores acoplados a proteínas G expresados en adipocitos (Gpr41 y Gpr43); Esto promueve la formación de adipocitos e inhibe la lipólisis [20]. Además, los AGCC regulan a la baja la síntesis de las hormonas supresoras del hambre leptina, el péptido YY y el péptido similar al glucagón 1 [21]. La microbiota intestinal también puede afectar al apetito y la saciedad a través de la activación del nervio vago o de mecanismos inmunoneuroendocrinos [19]. La microbiota intestinal también promueve el metabolismo de los ácidos biliares y modifica la homeostasis de los triglicéridos hepáticos y la glucosa a través del receptor X farnesoide [22]. La modulación de la microbiota intestinal con diferentes dietas y la suplementación con probióticos y fibras dietéticas es un enfoque prometedor para el tratamiento y la prevención de la obesidad [23].
2.1. El papel del aumento de la relación F/B en la obesidad
Un aumento de la relación F/B se asocia con la obesidad. Los estudios han examinado la relación F/B en humanos y animales delgados y obesos utilizando una amplia gama de métodos bioquímicos y biológicos moleculares, en los que la amplificación del gen ARNr 16S fue la más utilizada [24]. Uno de los primeros estudios que describió la correlación entre la relación F/B y la obesidad se realizó en 2005 mediante el análisis de bacterias cecales de ratones homocigotos obesos (ob/ob), heterocigotos obesos (ob/+) u homocigotos delgados (+/+). La relación F/B aumentó en ratones obesos y disminuyó en ratones delgados [25]. Otras pruebas sugirieron que la colonización de ratones libres de gérmenes con microbiota de ratones ob/ob o +/+ aumentó su grasa corporal total en un 47% o un 27%, respectivamente [26].
También se ha reportado una asociación entre la relación F/B y la obesidad en humanos. Una revisión sistemática publicada recientemente reveló que la mayoría de los estudios apoyan una relación entre una mayor relación F/B y la obesidad [27]. A continuación, presentamos algunos estudios ejemplares con más detalle. Un estudio en muestras de heces de sujetos japoneses obesos y no obesos reveló diferencias significativas en sus proporciones F/B. El porcentaje de Firmicutes fue del 37,0 ± 9,1% (en los no obesos) y del 40,8 ± el 15,0% (en los obesos), mientras que el porcentaje de Bacteroidetes fue del 44,0 ± el 9,8% (en los no obesos) y del 37,0 ± el 14,0% (en los obesos) [28]. Se informaron hallazgos similares en 61 adultos ucranianos en los que la relación F/B se asoció significativamente con el índice de masa corporal (IMC). Los individuos con una relación F/B de ≥ 1 tenían un 23% más de probabilidades de tener sobrepeso que aquellos con una relación F/B de <1 [29]. Del mismo modo, los sujetos qataríes (37 obesos y 36 delgados) presentaban una microbiota intestinal alterada; las relaciones F/B en sujetos obesos y delgados fueron de 2,25 ± 1,83 y 1,76 ± 0,58, respectivamente [30]. En los escolares kazajos [31] y belgas [32], la relación F/B fue significativamente mayor en los grupos obesos en comparación con la de los grupos de control. Por el contrario, varios estudios no observaron ninguna relación entre la relación F/B y la obesidad, el aumento de peso o el IMC. Las muestras fecales recogidas de adolescentes coreanos obesos (IMC ≥ 30 kg/m2) y normales (IMC < 25 kg/m2) (de 13 a 16 años) no revelaron diferencias significativas en la relación F/B entre los dos grupos (0,50 ± 0,53 (normal) frente a 0,56 ± 0,86 (obesos)). Sin embargo, hubo una diferencia en la prevalencia de dos géneros de Bacteroidetes: Bacteroides fue un 20% más prevalente en el grupo normal en comparación con el grupo obeso, y Prevotella fue un 19% más prevalente en el grupo obeso en comparación con el grupo normal [33]. Curiosamente, en los sujetos egipcios, tanto los filos Firmicutes como Bacteroidetes aumentaron en el grupo obeso en comparación con el grupo con peso normal [34].
Para aumentar la confusión, varios estudios demostraron hallazgos opuestos (es decir, disminución de la relación F/B en individuos obesos) [35,36]. Hay varias razones para estos resultados contradictorios. Presumiblemente, la asociación entre la relación F/B y la obesidad varía entre poblaciones específicas, grupos de edad, sexos y factores ambientales y genéticos [35], y, como ya se mencionó, otros filos (como Proteobacteria) pueden desempeñar un papel importante. Además, existe un número limitado de especies bacterianas específicas de los filos Firmicutes y Bacteroidetes que se asocian con la obesidad. Un estudio sobre las especies más importantes de Firmicutes y Bacteroidetes asociadas con la obesidad reveló una fuerte asociación entre la obesidad y las siguientes bacterias Firmicutes: Blautia hydrogenotrophica, Coprococcus catus, Eubacterium ventriosum, Ruminococcus bromii y Ruminococcus obeum. Por el contrario, las bacterias más comunes en individuos delgados fueron Bacteroides faecichinchillae, Bacteroides thetaiotaomicron (de Bacteroidetes) y Blautia wexlerae, Clostridium bolteae y Flavonifractor plautii (de Firmicutes) [36]. Estas diferencias se explicaron por la capacidad de ciertas bacterias, especialmente del filo Firmicutes, para producir más enzimas que son responsables de la degradación y fermentación de los carbohidratos. La especie R. bromii de Firmicutes se asocia con la obesidad y utiliza y degrada el almidón resistente mejor que Eubacterium rectale, B. thetaiotaomicron y Bifidobacterium adolescentis [37]. Curiosamente, ciertas especies de Bacteroidetes también poseen una variedad de genes para enzimas que degradan los carbohidratos [38]. A pesar de esto, la mayoría de los estudios apoyan la afirmación de que la bacteria Firmicutes tiene una mejor capacidad para fermentar y metabolizar carbohidratos y lípidos, y por lo tanto contribuir al desarrollo de la obesidad.
2.2. Tratamiento de la obesidad con probióticos
La manipulación de la microbiota intestinal con diferentes suplementos dietéticos puede contribuir al restablecimiento de la relación disbiótica F/B y al tratamiento o prevención de la obesidad. Consumidos a través de alimentos o suplementos, los probióticos pueden influir en la microbiota intestinal y reducir la obesidad. Sin embargo, no todos los probióticos tienen las mismas características, ya que algunos incluso pueden inducir el aumento de peso y, por lo tanto, promover la obesidad. Los probióticos que tienen el potencial de reducir la relación F/B y la obesidad son en su mayoría bacterias de los géneros Lactobacillus y Bacillus y levaduras del género Saccharomyces (Tabla 1).
Tabla 1. Los probióticos y sus efectos antiobesidad a través de la modulación de la relación F/B.

La administración de Lactobacillus rhamnosus GG y Lactobacillus sakei NR28 disminuyó la relación F/B en ratones obesos. Además, las dos cepas probióticas redujeron la masa grasa del epidídimo, la acetil-CoA carboxilasa, la sintasa de ácidos grasos y la estearoil-CoA desaturasa-1 en el hígado [39]. En otro estudio, L. rhamnosus GG consumido con una dieta alta en grasas evitó el aumento de peso y disminuyó la relación F/B en un modelo murino C57BL/6J [40]. El tratamiento de ratas hiperlipidémicas con L. rhamnosus hsryfm 1301 o su leche fermentada durante 56 días redujo los niveles de lípidos séricos, lo que se asoció con la recuperación de la disbiosis intestinal, y aumentó Bacteroidetes y disminuyó la abundancia de Firmicutes en aproximadamente un 5% [41]. Una dieta alta en grasas de 12 semanas indujo una condición obesa resistente a la insulina en ratas Wistar, ya que aumentó su peso corporal, la ingesta de alimentos, el colesterol total plasmático y la relación F/B, lo que indujo disbiosis intestinal. La administración oral del probiótico Lactobacillus paracasei HII01 junto con xilooligosacárido durante 12 semanas revirtió los efectos inducidos por la dieta alta en grasas al mejorar la sensibilidad a la insulina, disminuir los niveles de colesterol de lipoproteínas de baja densidad, reducir el peso corporal y reducir la relación F/B, revirtiendo así la disbiosis [42].
Las bacterias probióticas son bien conocidas por sus efectos antimicrobianos contra diversos patógenos. Sus mecanismos antimicrobianos son diversos; sin embargo, la producción de péptidos antibacterianos bacteriocinas se encuentra entre las más comunes. En un estudio en ratones obesos inducidos por la dieta, el Lactobacillus salivarius UCC118 Bac+ productor de bacteriocina alteró la microbiota intestinal y redujo el aumento de peso de forma más eficaz que la cepa no productora de bacteriocina L. salivarius UCC118 Bac-. Los autores informaron de un aumento de las proporciones de Bacteroidetes y Proteobacterias y una disminución de las proporciones de Actinobacterias, mientras que la proporción de Firmicutes se mantuvo igual [43]. Los efectos beneficiosos de L. salivarius también se demostraron en un ensayo clínico en humanos. L. salivarius El Ls-33 aumentó la relación Bacteroidetes-Prevotella-Porphyromonas-Firmicutes, pero no mostró ningún efecto beneficioso sobre el peso corporal en adolescentes obesos [44]. Además de Lactobacillus, las bacterias del género Bacillus, a saber, Bacillus amyloliquefaciens SC06, también disminuyeron la relación F/B, el peso corporal y la esteatosis hepática en ratones que consumían una dieta alta en grasas [45].
Aunque la mayoría de los probióticos son bacterias, otros microorganismos también se consideran probióticos. La levadura Saccharomyces boulardii ha demostrado efectos positivos sobre la obesidad y la relación F/B. La administración oral de S. boulardii a ratones obesos resistentes a la leptina y diabéticos tipo 2 durante cuatro semanas aumentó los bacterioidetes en un 37%, disminuyó los firmicutes en un 30% y redujo el peso corporal, la masa grasa, la esteatosis hepática y el tono inflamatorio [46]. Del mismo modo, Lei et al. confirmaron la relación entre S. boulardii y la relación F/B en ratones con lesión hepática inducida por D-galactosamina. Los ratones tratados con S. boulardii, en comparación con el control, tuvieron un aumento significativo de Bacterioidetes (61,7% vs. 40,8%) y una disminución de Firmicutes (33,9% vs. 53,7%) [47].
En algunos casos, los efectos antiobesidad de los probióticos no están relacionados con la relación F/B. Por ejemplo, Lactobacillus curvatus HY7601 y Lactobacillus plantarum KY 1032 ejercieron un aumento de peso corporal un 38% menor, pero no afectaron la relación F/B en ratones obesos inducidos por la dieta [48]. En un ensayo de intervención doble ciego, aleatorizado y controlado con placebo en humanos, se administró Lactobacillus gasseri SBT2055 a sujetos con un IMC alto. Los sujetos recibieron leche fermentada con o sin probiótico, y la circunferencia del peso corporal (1,4%), el IMC (1,5%), la cintura (1,8%) y la cadera (1,5%) disminuyeron significativamente en el grupo probiótico, pero no en el grupo control. Además, la relación F/B no se vio afectada [49].
En general, los probióticos no se pueden utilizar como terapia universal contra la obesidad. Como se mencionó anteriormente, no todos los probióticos demostraron la capacidad de reducir el peso corporal o ejercer efectos contra la obesidad. Por el contrario, Lactobacillus reuteri [50] y algunas bifidobacterias [51] se asociaron con un aumento del peso corporal y obesidad. Para los estudios de los probióticos y su papel en la obesidad, independientemente de sus efectos sobre la relación F/B, se remite al lector a otro lugar [52,53,54].
3. El papel de la microbiota intestinal en la EII
La EII representa un grupo de trastornos intestinales, caracterizados por un complejo de reacciones inflamatorias en el intestino delgado y grueso. La EII engloba dos tipos de enfermedades inflamatorias: la colitis ulcerosa (CU) y la enfermedad de Crohn (EC). Las dos enfermedades se diferencian por su ubicación: la CU causa principalmente inflamación duradera en el colon y el recto, mientras que la EC causa inflamación en cualquier lugar del tracto digestivo, pero principalmente en el íleon, el colon o ambos [55]. La etiología exacta de estos trastornos inmunológicos no está clara; sin embargo, se sabe que la microbiota intestinal contribuye de manera importante al inicio y progresión de la EII. Ciertas especies bacterianas intestinales pueden adherirse a la mucosa intestinal e invadir las células epiteliales de la mucosa, lo que da lugar a una respuesta inflamatoria mediada por la producción del factor de necrosis tumoral α (TNF-α) por monocitos y macrófagos. El TNF-α desempeña un papel fundamental en una variedad de reacciones inmunomoduladoras y se asocia con la EII a través de la inducción de la apoptosis celular y la necroptosis [56]. La inhibición del TNF-α puede mejorar la salud de los pacientes y dar lugar a la remisión de la EII [57,58].
La microbiota intestinal también puede inducir reacciones inflamatorias a través de los receptores tipo Toll (TLR), que desempeñan un papel vital en la inmunidad intestinal y están relacionados con el desarrollo y la progresión de la EII. Los TLR mantienen la homeostasis intestinal, controlan las respuestas inmunitarias y dan forma a la microbiota [59]. Se expresan principalmente por las células inmunitarias; sin embargo, varias TLR también son expresadas por las células epiteliales intestinales y las células del tejido estromal del tracto gastrointestinal (las TLR-1-9 se expresan en el intestino delgado y grueso en humanos y ratones) [60]. La mayoría de los activadores de TLR son patrones moleculares asociados a patógenos (es decir, compuestos microbianos que se encuentran principalmente en bacterias gramnegativas). Los heterodímeros TLR-1/2 y TLR-2/6 reconocen lipopéptidos triacilados y diacilados, respectivamente [61], mientras que TLR-4 y TLR-5 pueden ser estimulados por lipopolisacáridos y flagelina, respectivamente [62]. En muchos casos de EII, se observó una expresión y mutaciones de TLR alteradas, y su inhibición desempeñó un papel beneficioso en la ralentización de la progresión de la EII [63]. Por el contrario, ciertos TLR desempeñan un papel protector y pueden prevenir la inflamación en el intestino delgado y grueso. Por ejemplo, TLR-9 reconoce el ADN bacteriano de CpG, y su activación se correlaciona con una mejora significativa en la reparación de heridas intestinales y la protección intestinal [64].
Además, varias bacterias intestinales influyen directa o indirectamente en la inmunidad innata y adaptativa y, por lo tanto, evocan o previenen la EII. Por ejemplo, los macrófagos en el intestino detectan señales microbianas que los activan para producir interleucina (IL)-1β [65]. Un grupo de 17 especies humanas y 46 murinos de Clostridium afectaron la diferenciación, función y acumulación de células T reguladoras en el colon de ratones, lo que resultó en un efecto antiinflamatorio y protector [66]. Los metabolitos de la microbiota intestinal también pueden proteger al huésped de la inflamación. Los AGCC aumentan la diferenciación de las células T reguladoras extratímicas a través del potenciador intrónico CNS1 [67]. Además, los AGCC promueven la síntesis de la citoquina inmunosupresora IL-10 en las células T efectoras [68] y combaten el estrés oxidativo en el intestino [69]. Estos hallazgos enfatizan el importante papel de los AGCC en la homeostasis intestinal y la lucha contra la EII.
3.1. El papel de una disminución de la relación F/B en la EII
Además de ser factores importantes para la obesidad, también se encontraron alteraciones en la relación F/B en muchos casos de EII. A diferencia de la obesidad, en la que se observó un aumento de la relación F/B, en la EII se ha observado una disminución de la relación F/B. Un estudio examinó la diversidad bacteriana en muestras fecales e identificó 13 ribotipos distintos de Firmicutes en pacientes con EC (n = 6) y 43 ribotipos distintos de Firmicutes en individuos sanos (n = 6) [70]. De manera similar, un estudio diferente examinó la diversidad microbiana de biopsias de pacientes con EC y CU y controles sanos. Se observó una disminución en la abundancia de Firmicutes; más precisamente, las bacterias de la clase Clostridia disminuyeron en los pacientes con EC, pero no en los pacientes con CU ni en los individuos sanos. Por el contrario, la abundancia de Bacteroidetes aumentó significativamente en los pacientes con EC en comparación con los pacientes con CU y los individuos sanos (74,97%, 64,31% y 67,41% respectivamente) [71]. Las alteraciones en la microbiota intestinal también se asociaron con la actividad de la enfermedad y la gravedad de la EC y la CU. Por ejemplo, Firmicutes fue menos abundante en los pacientes con CU con la enfermedad activa en comparación con los pacientes con la enfermedad inactiva. Del mismo modo, la abundancia de Firmicutes disminuyó significativamente en los pacientes con EC con la enfermedad agresiva en comparación con los pacientes con EC con la enfermedad no agresiva [72]. Faecalibacterium prausnitzii es una especie de Firmicutes que disminuyó en pacientes con EII, y su reducción se asoció con la recurrencia postoperatoria de la EC a los seis meses [73]. Además, F. prausnitzii demostró efectos antiinflamatorios in vivo e in vitro. En ratones con colitis inducida, F. prausnitzii vivo (o su sobrenadante) redujo la gravedad de la colitis y corrigió la disbiosis. Además, la estimulación in vitro de células mononucleares sanguíneas por F. prausnitzii provocó una mayor secreción de IL-10 y una menor secreción de IL-12 e interferón-γ (IFN-γ) [73].
Por el contrario, las bacterias Bacteroidetes a menudo aumentan en la EII y se asocian con su progresión y desarrollo. Las biopsias de mucosa de las regiones inflamadas y no inflamadas del intestino de pacientes con EII e individuos sanos revelaron una reducción de Firmicutes y un aumento de la abundancia de Bacteroidetes en las muestras de EII, mientras que las enterobacterias aumentaron solo en pacientes con EC. Las biopsias también revelaron una mayor disbiosis bacteriana en las regiones inflamadas en comparación con las regiones no inflamadas [74]. Otro estudio en el que se realizaron biopsias de mucosa y extracción de ARN en pacientes con EC y CU demostró una alteración de la microbiota intestinal y de la relación F/B. La relación F/B tanto en los pacientes con EC como en CU disminuyó significativamente en comparación con la del grupo control; Además, se modificó la composición de especies, géneros y familias. La abundancia de Bacteroides y Lactobacillus fue mayor en los pacientes con CU en comparación con los pacientes con EC y el grupo control; la abundancia de Escherichia coli también aumentó en los pacientes con CU en comparación con el grupo control. Por el contrario, Clostridium coccoides y Clostridium leptum se redujeron en pacientes con EC [75]. Además de las biopsias, también se ha examinado la disbiosis intestinal en muestras fecales. Las muestras microbianas fecales de pacientes japoneses con EC tenían una abundancia significativamente mayor de Bacteroides en comparación con la de individuos sanos. Además, la abundancia de Faecalibacterium y Bifidobacterium disminuyó significativamente en los pacientes con EC [76]. De manera similar, los pacientes japoneses con CU hospedaron bacterias que no se detectaron en individuos sanos, incluidos Ruminococcus, Eubacterium, Fusobacterium, Gammaproteobacteria, Bacteroides no clasificados y Lactobacillus no clasificados [77]. Diferentes bacterias Bacteroidetes se asociaron con diversos grados de EII. En una línea de ratones pretratados con antibióticos con defectos en la señalización del factor de crecimiento transformante (TGF)βRII e IL-10R2, se observó una enfermedad ulcerosa grave después de la sonda nasogástrica con Bacteroides vulgatus y B. thetaiotaomicron, mientras que Bacteroides sp. TP5 indujo solo una enfermedad más leve que consistió en la infiltración linfocítica en la mucosa [78].
De manera análoga a los estudios que mostraron poco efecto de la relación F/B sobre la obesidad, tampoco se observó una disminución de la relación F/B en todos los casos de EII. Un análisis microbiano fecal de pacientes con EII de Kazán reveló una disminución de la abundancia de Bacteroidetes, Firmicutes y Verrucomicrobia, mientras que la abundancia de Proteobacterias, Actinobacterias y Fusobacterias aumentó [79]. En 48 pacientes con CU, el número de copias bacterianas de Bacteroides en muestras fecales fue inferior al 10% del de individuos sanos, y el subgrupo XIVab de Clostridium (Firmicutes) también fue significativamente menor [80]. Las poblaciones bacterianas en los pacientes con EII difieren entre las diferentes regiones intestinales. Por ejemplo, en un estudio de 40 pares de gemelos con EII, los pacientes con EC colónica tenían más Firmicutes que los sujetos sanos, mientras que los pacientes con EC de íleon tenían menos. A nivel familiar, los pacientes con EC colónica presentaron una mayor cantidad de Ruminococcaceae (filo Firmicutes), mientras que esta familia se redujo en los pacientes con EC ileal [81]. Sin embargo, la mayoría de los estudios han demostrado que la bacteria Bacteroidetes exhibe propiedades proinflamatorias debido a las endotoxinas e influye en la producción de citoquinas, contribuyendo a la EII. Además, la bacteria Firmicutes exhibe efectos antiinflamatorios y puede aliviar la progresión de la EII.
3.2. Tratamiento de la enfermedad inflamatoria intestinal (EII) con probióticos
Ciertas cepas probióticas se pueden utilizar para el tratamiento de la EII mediante la regulación de la homeostasis intestinal. Aunque la mayoría de los probióticos que ejercen efectos antiinflamatorios en pacientes con EII son bacterias del filo Firmicutes, solo algunos de ellos pueden influir en la relación F/B. En la Tabla 2 se enumeran los géneros Lactobacillus y Bifidobacterium que presentan propiedades terapéuticas contra la EII y la alteración de la microbiota intestinal.
Tabla 2. Los probióticos y sus efectos antiinflamatorios a través de la modulación de la relación F/B.

La administración temprana de L. reuteri DSM 17938 a ratones C57BL/6J de 8 días de edad afectó a la homeostasis microbiana intestinal al aumentar la abundancia relativa de Firmicutes y disminuir la abundancia relativa de Bacteroidetes. La sonda probiótica aumentó aún más la proporción de células T reguladoras de FoxP3+ en el intestino de los ratones, al tiempo que redujo su proporción en los ganglios linfáticos mesentéricos. Esto puede indicar que L. reuteri DSM 17938 apoya el tráfico de células T reguladoras desde los ganglios linfáticos hasta el intestino [82]. L. plantarum AN1 vivo y muerto administrado a través del agua potable a modelos murinos de EII mostró propiedades moduladoras y antiinflamatorias intestinales. Tanto las bacterias vivas como las muertas por calor aumentaron la abundancia de Firmicutes y disminuyeron la abundancia de Bacteroidetes en los modelos murinos de EII. El probiótico también ejerció efectos antiinflamatorios in vitro al producir óxido de nitrógeno y proteger las células RAW264.7 contra la toxicidad del peróxido de hidrógeno [83]. La combinación de dos probióticos diferentes (L. plantarum ZDY2013 y Bifidobacterium bifidum WBIN03) redujo la CU en ratones mediante la modificación de la microbiota intestinal y la reducción de la inflamación y el estrés oxidativo. La mezcla de probióticos aumentó la abundancia de Firmicutes no identificados y redujo la abundancia de varias familias bacterianas, incluyendo Bacteroidetes (Bacteroidales S24-7). Además, los dos probióticos regulaban a la baja el TNF-α y regulaban al alza los factores antioxidantes en ratones con colitis ulcerosa [84]. L. plantarum es uno de los probióticos más utilizados contra la EII. Sus mecanismos de acción en la prevención y tratamiento de la EII son diversos [92] e incluyen la producción de bacteriocinas. En modelos de ratones inducidos por EII, Yin et al. compararon los efectos de L. plantarum NCIMB8826 de tipo salvaje y su mutante L. plantarum LM0419, que carece del gen de la bacteriocina plantaricina. Los ratones que recibieron L. plantarum LM0419 tenían niveles similares de TNF-α e IL-6 que el grupo de control que no recibió bacterias, mientras que el grupo que recibió L. plantarum NCIMB8826 tuvo niveles más bajos de citocinas inflamatorias. Además de reducir las citoquinas proinflamatorias, L. plantarum NCIMB8826 (pero no LM0419) también alteró la disbiosis microbiana de la EII. El género Parabacteroides, que fue abundante después de la inducción de la EII, se redujo después de la administración de L. plantarum NCIMB8826 [85]. Otros lactobacilos también han demostrado ser eficaces para modular la disbiosis y disminuir la inflamación. Lactobacillus fermentum KBL374 y L. fermentum KBL375 alteraron la microbiota intestinal en ratones con colitis inducida por sulfato de sodio de dextrano. La administración de sulfato sódico de dextrano aumentó significativamente las proporciones de Bacteroides y Mucispirillium, pero disminuyó Lactobacillus. La administración conjunta de L. fermentum KBL374 y L. fermentum KBL375 corrigió la disbiosis intestinal, disminuyó las proporciones de los dos géneros y aumentó la proporción de Lactobacillus. L. fermentum KBL374 y KBL375 también aumentaron la proporción de la población de células T reguladoras CD4 + CD25 + Foxp3+, disminuyeron los niveles de citoquinas proinflamatorias (IFN-γ, IL-4, IL-13, IL-6, TNF, IL-17A, IL-1β, CCL2 y CXCL1) y aumentaron los niveles de citoquinas antiinflamatorias IL-10 [86].
A pesar de que el filo Bacteroidetes está relacionado con la inflamación y la EII, algunos estudios indican que ciertos probióticos pueden ejercer efectos antiinflamatorios al aumentar la abundancia de Bacteroidetes. Por ejemplo, la administración de Lactobacillus casei variedad rhamnosus (Lcr 35) a niños con diarrea aguda aumentó la abundancia de Firmicutes y Bacteroidetes, aumentando la IgA fecal total y disminuyendo los niveles de lactoferrina y calprotectina [87]. Resultados similares se mostraron en otro ensayo clínico en el que pacientes con EII recibieron un yogur probiótico que contenía Lactobacillus acidophilus La-5 y Bifidobacterium animalis subsp. lactis BB-12. Los números medios de Lactobacillus, Bifidobacterium y Bacteroides en los pacientes que recibieron yogur aumentaron significativamente en comparación con el grupo de control [88]. Por el contrario, la leche fermentada con bifidobacterias redujo la proporción relativa de B. vulgates del filo Bacteroidetes. Durante un período de un año del ensayo, solo tres de 11 pacientes (27%) que recibieron leche fermentada con bifidobacterias experimentaron una exacerbación de los síntomas de la CU, mientras que nueve de cada 10 pacientes (90%) experimentaron una exacerbación de los síntomas en el grupo de control [89]. Las bifidobacterias también alteraron la microbiota intestinal en personas mayores. El consumo diario de 250 ml de leche descremada que contiene Bifidobacterium lactis HN019 aumentó el número de residentes de bifidobacterias, enterococos y lactobacilos, y redujo los recuentos de enterobacterias [90].
El probiótico VSL#3 se encuentra entre los productos probióticos más utilizados contra la EII y está compuesto por bacterias vivas liofilizadas altamente concentradas que incluyen cuatro lactobacilos (L. plantarum, L. casei, L. acidophilus y L. delbrueckii subsp. bulgaricus), tres bifidobacterias (B. longum, B. breve y B. infantis) y un Streptococcus salivarius subsp. thermophilus [93]. Sus efectos antiinflamatorios y protectores fueron probados tanto en estudios en animales [94] como en humanos [95]. Sin embargo, se dispone de pocos datos sobre la correlación de la VSL#3 con la EII y la alteración de la microbiota intestinal. Rossi et al. realizaron un análisis de los efectos antiinflamatorios de VSL#3 en perros domésticos diagnosticados con EII. La terapia VSL#3 redujo significativamente la infiltración de linfocitos T CD3+, mejoró los marcadores reguladores de linfocitos T (FoxP3+ y TGF-β+) y aumentó la abundancia de Faecalibacterium [91]. Como se mencionó anteriormente, Faecalibacterium es uno de los géneros de Firmicutes más importantes en la EII, con F. prausnitzii ejerciendo efectos antiinflamatorios y protectores en el intestino [73]; por lo tanto, su abundancia es importante en los pacientes con EII. Además de los probióticos, la abundancia de F. prausnitzii se incrementó con diferentes prebióticos como el almidón de maíz butirilado con alto contenido de amilosa [96], la inulina [97] y las cápsulas de kiwi [98].
Además de contribuir a equilibrar la relación F/B, muchos probióticos reducen la inflamación intestinal mediante otros mecanismos, como la mejora de la barrera celular epitelial, la modificación de las células epiteliales e inmunitarias y la modificación de la síntesis de citoquinas. Para estos estudios sobre los probióticos y sus propiedades antiinflamatorias, se remite al lector a otras revisiones [99,100].
4. Conclusiones
En esta revisión, resumimos las propiedades de los dos filos bacterianos más importantes que se encuentran en el intestino, Firmicutes y Bacteroidetes, y su papel en el mantenimiento de la homeostasis en el huésped. Una proporción equilibrada entre estos dos filos es importante para mantener la salud, y las alteraciones en la proporción se asocian con el desarrollo de disbiosis intestinal y ciertas enfermedades como la obesidad y la EII.
Las bacterias Firmicutes son Gram-positivas y juegan un papel clave en la nutrición y el metabolismo del huésped a través de la síntesis de AGCC. A través de sus productos metabólicos, las bacterias Firmicutes están conectadas indirectamente con otros tejidos y órganos y regulan el hambre y la saciedad. Por el contrario, las bacterias Bacteroidetes son gramnegativas y se asocian con inmunomodulación. Sus componentes, lipopolisacáridos y flagelina, interactúan con los receptores celulares y potencian las reacciones inmunitarias a través de la síntesis de citoquinas.
El aumento o la disminución de la relación F/B se asocian con el desarrollo de obesidad o EII, respectivamente. Los probióticos más utilizados en el tratamiento de la disbiosis intestinal son las bacterias de los géneros Lactobacillus y Bifidobacterium, así como la levadura S. boulardii. Restaurar la proporción F/B con los probióticos adecuados puede reducir el aumento de peso o suprimir el sistema inmunológico. Los probióticos que reducen el peso y disminuyen la relación F/B son L. rhamnosus, L. sakei, L. paracasei, L. salivarius, B. amyloliquefaciens y S. boulardii. Además, el aumento de la relación F/B con probióticos se asocia con inmunosupresión y efectos protectores en el intestino. Los probióticos más eficaces con estas propiedades son L. reuteri, L. plantarum, L. fermentum, L. casei variedad rhamnosus (Lcr 35), L. acidophilus, B. lactis, B. bifidum y VSL#3.
En general, los probióticos seleccionados pueden afectar a la disbiosis F/B y contribuir a reducir la obesidad y la inflamación intestinal. Sin embargo, los diferentes probióticos ejercen diferentes efectos sobre la relación F/B. Por lo tanto, la elección de la cepa o mezcla probiótica adecuada es crucial para obtener los efectos terapéuticos más óptimos. Se necesitan más estudios para identificar cepas de bacterias Firmicutes y Bacteroidetes que desempeñan un papel crucial en la salud y la homeostasis, así como para establecer enfoques que modulen la concentración o composición de las bacterias Firmicutes y Bacteroidetes.

